Massenspektrometrie
Prinzip: In der MS wird eine Substanz in einer Ionisierungskammer
(unter hohem Vakuum) mit einem Ionisator gewisser Energie bombardiert und somit aufgespalten. Die Fragmente des Moleküls (Kationen oder radikale Kationen) werden in hohem Vakuum mit einem Magnetfeld beschleunigt und nach Ihrem Masse/Ladungs -Verhältnis (m/z) getrennt.
Dieses Verhältnis ist gleich der Molekularen Masse des Fragments.
Gebieten und es gibt eine Menge an Methodenkombinationsmöglichkeiten.
- der quantitativen und qualitativen Analyse komplex
zusammengesetzter Proben.
(wegen dem hohen Nachweis- und Auflösungsvermögen der MS.)
- zur Aufklärung der Struktur organischer Moleküle einschließlich der
- zur Isotopentrennung bzw. der Ermittlung derer Verhältnisse in der
Probe.
- der Partikelanalyse (z.B. Lokalisierung und Identifizierung eines Ölfilms
auf Metalloberflächen)
MS-Kombinationen wie GC/MS, HPLC/MS, Tandem MS, u.v.m lassen leistungsstarke Analysengeräte entstehen. Das Tripplestage Quadrupol -Geräte (3 Quadrupole in Serie) läßt interessante Experimente in der Spurenanalytik zu.
Im Prinzip kann man alle Arten von Geräten mit der MS koppeln.
Aufbau:
- Pumpe
- Einlaßsystem
- Ionenquelle
- Trenn- bzw. Analysensystem
- Detektor
- Auswerteeinheit
Pumpe: Der MS Prozeß funktioniert nur unter hohem Vakuum, hauptsächlich
um ein ungehindertes durchströmen der Molekülfragmente durch die Analysenröhre und eine somit reproduzierbare Massenanalyse zu gestatten.
Der Teilchenfreie Raum muß größer sein als die Entfernung zwischen der Ionisierungskammer und dem Detektor.
Die Vakuum Anforderungen sind nicht sehr hoch: 10-4 - 10-5 torr* sind charakteristisch.
Das Vakuum ist für den Betrieb des Detektors notwendig.
Deswegen wird das Vakuum gleich als Isolator verwendet
Es werden hohe Spannungen verwendet
Das Betreiben des Detektors in Abwesenheit kann zu
schwerwiegendem Sachschaden führen !
Die meisten Instrumente verweigern den Betrieb wenn das Vakuum
nicht hoch genug ist.
Das Vakuum wird durch die Kombination 2er Pumpen produziert.
Eine Rotorpumpe dient als Vorpumpe. Sie kann ein Vakuum von 10-2 -
torr. produzieren.
Um ein Vakuum mit einen Bereich von 10-5 torr zu bekommen wird entweder
eine Turbomolekular- oder eine Diffusionspumpe verwendet.
Diese Pumpen verhalten sich eigentlich wie Kompressoren.
![]()
) 1 torr 133,3226 Pa
Die Öldiffusionspumpe:
Vorteile:
Zuverlässig
Beinahe wartungsfrei
Leise
Nachteile:
braucht lang zum Warmlaufen (über Nacht)
schlechtes Design kann zur Verunreinigung des Analysators führen
Einlaßsystem: Der Einlaß (µmol -Bereich) sollte ohne großen Vakuums-
verlust erfolgen.
Indirekt Die Probe wird gasförmig in das Spektrometer eingebracht,
deswegen müssen feste und flüssige Proben bei Temperaturen bis 500°C verdampfbar sein. Dies geschieht in einem Vorratsbehälter, die gasförmige Probe wird mittels einer Effusionsdüse in die Ionenquelle gebracht.
- Basiert auf der relativen Rate
der Diffusion.
- kleine Moleküle diffundieren
schneller, die meisten werden
den MS-Einlaß verfehlen.
-größere Moleküle diffundieren
langsam und können den Einlaß
Effusionsdüse:
Vorteile:
Relativ einfache und kostengünstige Methode
Nachteile:
Diffusionsrate ist massenabhängig.
Sollte die Düse teilweise verstopft werden, bekommt man einen
hervorragenden Trägergas Detektor.
Das erforderliche Vorvakuum soll ~10-4 Pa betragen.
Direkt: Für schlecht verdampfbare Verbindungen. Die Substanzen werden
unter Verwendung einer Schubstange direkt in die Ionenquelle geschleust.
Hier reichen Mengen im Nanogramm -Bereich aus, da weniger Substanzverlust
auftritt.
Unter Kopplung mit einem Chromatographen:
Open split Schnittstelle (bei GC/MS)
Vorteile:
Jede Gasquelle kann verwendet
Werden.
relativ billig, einfach zu bedienen.
Nachteile:
Analyt verläßt Säule geteilt
Split ändert sich mit Flußrate
Kapillaren Direkt Schnittstelle (GC/MS):
Vorteile:
billige, einfache Vorrichtung
kein Totvolumen
keine Selektivität
Nachteile:
limitiert Flußweite
limitiert den ID der benutzten
Säule
ein Teil der Säule dient als
Flußeinschränkung
(d.h. er ist ,verloren')
Ionenquelle: Zur Ionisation der Probenmoleküle nutzt man Elektronen,
Ionen, Moleküle, Photonen sowie elektrische und/oder thermische Energie.
Oft sind die Ionenquellen in die Einlaßsysteme integriert.
Die Wahl der Ionenquelle hängt von der Probensubstanz und der gewünschten Information ab. ,Soft ionisation' -Methoden wie die Feld-desorption und die Elektrospray ionisation tendieren zu Massenspektren mit wenigen oder gar keinen
Fragment-Ionen.
Gasphasen Ionisierung:
Elektronen Ionisierung (EI): Auch als ,Electron impact' Ionisation bekannt, ist
sie die älteste und best beschriebene Ionisationsmethode.
Ein Elektronenstrahl passiert die Gas/Proben -Phase. Wenn nun ein e- mit einem neutralen Molekül zusammenprallt, kann es ein anderes Elektron herausschlagen und ein positiv geladenes Ion ist die Folge.
Dieser Prozeß kann in einem molekularen Ion (hat dieselbe Masse wie das
Anfangsmolekül) oder in einem Fragment Ion enden.
Das Ionisationspotential ist die Elektronen Energie die benötigt wird um ein molekulares Ion zu produzieren. Das Scheinpotential eines gewissen Fragment Iones ist jene Energie die dieses Fragment Ion hervorbringen wird. Die meisten MS verwenden Elektronen mit 70eV. Setzt man die e- Energie herab, so wird die
Fragmentierung reduziert aber es werden auch weniger Ionen gebildet.
Vorteile:
einfach, verständlich
kann praktisch für alle (leicht) flüchtigen Stoffe verwendet werden
reproduzierbare Massenspektren
Fragmentierung läßt auf Struktur zurückschließen
Spektren können mit ,Fingerprint' (in Literatur) verglichen werden
Nachteile:
Probe muß flüchtig und relativ stabil sein
Molekulares Ion kann schwach oder gar nicht vorhanden sein
Massen Bereich:
klein, Typisch weniger als 1,000 Da.
Chemische Ionisierung (CI): Nutzt Ion- Molekül -Reaktionen um Ionen
aus dem Analyten zu bilden. Der Ionisatzionsprozeß beginnt mit einem Gas-Reagenten (z.B. CH4, i-Butan, NH4) welches mittels EI ionisiert wird.
Durch einen hohen Reagentgasdruck (bzw. eine lange Reaktionszeit) wird die Reaktion gestartet, auch manche Fragment Ionen reagieren mit Analyt
Molekülen zu Analyt Ionen.
Beispiel: (R= Reagent, P= Probe, = Radikal)
R + e- R+ + 2e-
R+ + RH RH+ + R
RH+ + P PH+ + R
(natürlich gibt es noch andere Reaktionsmöglichkeiten)
Vorteile:
gibt oft Molekül Gewichtsinfo durch Molekülähnliche Ionen
wie z.B. [M+H]+ auch wenn die EI kein solches Ion bilden würde
simple Massenspektren, Fragmentation reduziert im Vergleich mit EI
Nachteile:
Probe muß flüchtig und stabil sein
Geringere Fragmentation als bei EI, Fragmentmuster nicht besonders
Informativ oder reproduzierbar genug für penible Analysen
Massen Bereich:
klein, Typisch weniger als 1,000 Da.
Desorptionschemische Ionisation (DCI Dies ist eine Variation der CI
bei der der Analyt auf einem Filamentdraht plaziert wird welches rapide im CI Plasma erhitzt wird. Die direkte Exposition zu den CI Reagentionen, kombiniert mit hurtigem Erhitzen reduziert die Fragmentation. Manche Proben die thermisch nicht
desorbiert werden ohne zu zerfallen, können Mittels Pyrolysen -DCI
charakterisiert werden.
Vorteile:
reduzierte thermische Zersetzung
schnellere Analyse
relativ einfaches Gerät
Nachteile:
nicht sehr reproduzierbar
schnelles Erhitzen erfordert schnelle Scangeschwindigkeiten
versagt bei großen oder labilen Verbindungen
Massen Bereich:
klein, Typisch weniger als 1,500 Da.
Negative-Ionen-chem. Ionisation (NCI): Nicht alle Verbindungen bilden
negative Ionen, viele wichtige können dies jedoch unter den richtigen Bedingungen. Für solche Verbindungen ist die Negative Ionen MS viel effizienter,
sensitiver und selektiver als die Positive Ionen MS.
Negative Ionen können durch viele Prozesse gebildet werden.
Die ,Resonance elektron capture' -Methode bezieht sich auf das Einfangen eines Elektrons durch ein neutrales Molekül. Die e- -Energie ist gering und die spezifische Energie die zum Einfangen eines e- benötigt wird, ist abhängig von der
Molekülstruktur des Analyten.
Das Anhängen eines e- ist ein endothermer Vorgang.
Manche -so entstandenen molekularen Anionen fassen diesen Energie-überschuß, andere können das e- verlieren oder zerfallen um
Fragmentanionen zu hervorzubringen.
In der NIC verlangsamt ein Puffergas (meist wie bei der CI) die Elektronen bis sie die richtige Energie haben um eingefangen zu werden. Das Puffer-
gas kann die energiereichen Atome stabilisieren und die Fragmentierung reduzieren. Eigentlich ist das ein physikalischer und kein chemischer
Ionisationsvorgang.
Vorteile:
effiziente Ionisierung, hohe Empfindlichkeit
weniger Fragmentierung als bei pos. EI/CI
höhere Selektivität bei gewissen biologisch oder umweltanalytisch
wichtigen Verbindungen
Nachteile.
nicht alle flüchtigen Verbindungen ergeben negative Ionen
schlechte reproduzierbarkeit
Massen Bereich:
klein, Typisch weniger als 1,000 Da.
Feld Desorption und Ionisierung:
Diese Methoden basieren auf dem Tunneleffekt.
Ein e- durchtunnelt einen Emitter mit einem hohen el. Potential. Der Emitter ist eigentlich ein Filament auf dem feine kristalline Spitzen gezüchtet werden. Wenn eine hohe Spannung angelegt wird, existiert an diesen Spitzen ein hohes el. Feld welches dem e- erlaubt gewisse Barrieren zu durchtunneln. Es werden Kohlenstoff- und Silizium- Emitter verwendet. Si- Emitter sind robuster und halten größere Spannungen aus und sind überdies auch relativ billig. C- Emitter haben
eine höhere Selektivität, nur sind sie leider etwas teurer.
FD und FI sind sanfte Methoden welche MSpektren mit geringen Fragment-
Ionen Gehalt erzeugen.
Feld Desorption (FD): Die Probe wird auf den Emitter gebracht, dieser
dann auf ein hohes Potential (einige kV) ausgerichtet und mit Anbringen einer Spannung erhitzt. Sobald der Emitterstrom langsam ansteigt und die Probe in die
Gasphase überführt wird, werden die Analytmoleküle zunehmend von den
tunnelnden e- ionisiert.
Die Probe wird direkt auf den Emitter gebracht.
Das geschieht entweder indem man
den Emitter direkt in die Lösung taucht
das gelöste oder suspendierte Material direkt darauf gibt
Vorteile:
einfache MSpektren
wenig bis gar kein chemischer Hintergrund
funktioniert gut mit kleinen organischen Molekülen, vielen Organo-
metallen, LMW Polymeren und manchen petrochemischen Fraktionen
Nachteile:
empfindlich zu Alkalimetall -Kontamination und Probenüberlastung
Der Emitter ist relativ zerbrechlich
relativ langsame Analyse, da der Stromfluß erst ansteigen muß
die Probe sollte thermisch beständig sein um desorbiert werden zu
können
Massen Bereich:
klein bis mäßig. Probenabhängig. Typisch weniger als 2,000 - 3,000 Da
es wurden aber schon Ionen mit M > 10,000 Da gemessen
Feld Ionisation (FI): Die Probe wird aus einer direkten Probenaufgabe
verdampft (beheiztes Einspritzsystem wie bei GC bzw. gasförmige Probe).
Wenn das Gas den Emitter passiert wird es durch die tunnelnden e- ionisiert.
Vorteile:
wie Feld Desorption
Nachteile:
Probe muß thermisch beständig sein und wird wie bei der Elektronen
Ionisation (EI) eingebracht
Massen Bereich:
klein, typisch < 1,000 Da
Teilchen Beschuß:
In diesen Methoden wird die Probe auf einem Target mit Atomen, Ionen oder neutralen Teilchen beschossen. Am häufigsten wird der Analyt in einer flüssigen Matrix mit geringer Beständigkeit gelöst und mit einem relativ hohen Teilchenstrom bombardiert. (FAB oder dynamische SIMS)
Andere Methoden verwenden einen relativ geringen Teilchenfluß und keine flüssige Matrix. (statische SIMS) Die letzteren Methoden werden aber eher zur Oberflächen-analyse verwendet. In diesem Prozeß gibt es 2 Teilchenstrahlen. Der primäre
bombardiert und der sekundäre Ionen -Strahl besteht aus den resultierenden Ionen.
Fast Atom Bombardment (FAB): ein kleiner Teil ( ~1µl) des in einer
Matrix aus Glycerin, Thioglycerin, m-Nitrobenzyl Alkohol oder Diethanolamin gelösten Analyten wird auf dem Target plaziert und mit einem schnellen Atomstrahl (z.B. 6keV Xe) beschossen. Diese Atome desorbieren Molekülähnliche Ionen und Fragmente aus dem Analyten. (Cluster -Ionen aus der Matrix werden ebenfalls desorbiert und ein kleines chemisches Hintergrundrauschen, abhängig
von der Matrix ist die Folge)
Die Probe wird entweder direkt oder über LC/MS -Kopplung (frit FAB oder
continuous-flow FAB) eingebracht.
Vorteile:
schnell
einfach
Unterschiede in der Probennahme gegenüber relativ tolerant
gut für eine große Vielfalt an Verbindungen
starke Ionenströme => gut für hochaufgelöste Messungen
(FAB)
Nachteile:
hohes chemisches Hintergrundrauschen legt Detektionslimit fest
Unterscheidung zwischen niedermolekularen Vbdg. und
Hintergrundrauschen oft schwierig
Analyt sollte in Matrix löslich sein
nicht besonders gut geeignet für Vbdg. mit mehr als 2 Ladungen
Massen Bereich:
mäßig, typischerweise ~300 bis 6,000 Da
Sekundär Ionen MS (SIMS) -dynamisch! Die SIMS ist der FAB beinahe
ident. Nur ist hier der primäre Strahl ein Ionenstrahl (meist Cs Ionen). Die Ionen können Fokussiert und auf höhere Geschwindigkeiten beschleunigt werden. Daraus ergibt sich eine höhere Massenempfindlichkeit.
Ansonsten ist sie wie die FAB.
Die Verwendung von SIMS für Proteine und Peptide mit mittlerer Größe
(3,000 - 3,000 Da) wurde größtenteils durch Elektrospray Ionisation verdrängt.
Vorteile:
wie FAB, nur wird die Empfindlichkeit verbessert
(Massen von 3,000 - 13,000 Da)
Nachteile:
wie FAB
Target kann sich erhitzen da energetischerer Primärstrahl
hochspannungs Bögen häufiger als bei FAB
generell öftere Instandhaltung der Ionenquelle als bei FAB
Massen Bereich:
mäßig, charakteristisch sind Massen von 300 bis 13,000 Da
Spray Methoden:
Hier wird eine Lösung des Analyten bei Atmosphärendruck in eine Schnittstelle zum Vakuum der MS Ionenquelle. Eine Kombination von thermischen und pneumatischen Vorgängen dient der Desolvatation der Ionen wenn sie die Ionenquelle betreten.
Lösungs- Flußraten können von <1µl bis einige Millimeter variieren. Diese Methoden
eignen sich gut für LC/MS -Kopplungen
Elektrospray Ionisation (ESI): Die Probelösung wird über eine hohe
Potentialdifferenz (einige kV) aus einer Nadel eingebracht. Hitze Gasströme
desolvatisieren die Probenionen.
ESI kann vielgeladene Ionen hervorbringen, wobei die Ladungsanzahl mit der
Masse steigt. Die Ladungsanzahl einer gegebenen Ionenart muß nach folgenden
Methoden bestimmt werden:
Vergleich zweier Ladungszustände welche sich um eine Ladung
unterscheiden (und Berechnung dieser in Simultangleichungen)
Arten der selben Ladung aber unterschiedlicher Adduktionsmasse
vergleichen
Masse/Ladungs- Verhältnis für gelöste Isotopen -Cluster
Die Probe wird über Flußinjektion oder LC/MS eingebracht.
Vorteile:
geeignet für geladene, polare oder einfache Verbindungen
erlaubt Detektion Verbindungen großer Masse mit Masse-Ladungs Verhältnissen die einfach von vielen MS bestimmt werden können
(m/z typischerweise < 2,000 - 3,000)
Die beste Methode zur Analyse von Multiladungsverbindungen
geringes chemisches Hintergrundrauschen => exzellente
Detektionslimits
Gegenwart oder Abwesenheit von Fragmentation mit
Schnitstellenlinsenpotential steuerbar
Kompatibel mit MS/MS -Methoden
Nachteile:
Multiladungsarten müssen mathematisch interpretiert werden
komplementär zur APCI. Ungeeignet für ungeladene wenigpolare Vbdg.
(z.B. Steroide)
hochempfindlich zu Verunreinigungen (z.B. Alkalimetalle)
relativ kleine Ionenströme
benötigt relativ komplexe Hardware im Vergleich zu anderen
Ionenquellen
Massen Bereich:
Niedrig bis Hoch. Typ. < 200,000 Da
Atmospheric Pressure Chemical Ionisation (APCI): Diese Schnittstelle
ist der ESI komplementär. Hier ionisiert eine Corona-Entladung den Analyten in
der Atmosphärendruckregion. Gasphasen-Ionisation ist gegenüber der ESI
effektiver bei wenigpolaren Arten.
Vorteile:
geeignet für wenigpolare Verbindungen
exzellente LC/MS -Schnittstelle
kompatibel mit MS/MS Methoden
Nachteile:
Komplementär zur ESI
Massen Bereich:
Niedrig bis Mittel. Typ. < 2,000 Da
Laser Desorption:
Diese Methoden verwenden einen Puls-Laser um Arten von einer Targetoberfläche zu desorbieren. Deswegen muß man Detektoren wie den TOF (Time-of-flight) oder den FTICR (Fourier transform ion cyclotrone resonance) welcher mit gepulsten Ionisationsmethoden kompatibel ist. Magnetsektor MS die mit einem Massenarray
ausgerüstet sind können für die Detektion von Ionen aus MALDI verwendet werden.
Die direkte Laser Desorption verläßt sich auf rapides Erhitzen der Probe um Moleküle so schnell wie möglich zu verdampfen, daß sie keine Möglichkeit haben zu zerfallen. Das ist gut für klein- bis mittel-molekulargewichts Vbdg. und Oberflächen-analysen. Die erst kürzlich entwickelte Technik der Matrix-assistierten Laser Desorptions Ionisation (MALDI) verläßt sich auf die Absorption von Laserenergie von
einer Matrixverbindung. MALDI ist eine populäre Methode zur schnellen Bestimmung
von Hoch-Molekulargewichts Verbindungen.
Matrix Assistierte Laser Desorptions Ionisation (MALDI):
Der Analyt liegt in einer Lösung mit einem Überschuß an einer Matrix (wie Sinapinsäure oder Dihydroxybenzoesäure) welche ein Chromophor enthält, daß die Wellenlänge des Lasers absorbiert. Ein kleiner Anteil dieser Lsg. wird auf dem
Lasertarget plaziert. Wenn nun die Matrix die Laserenergie absorbiert, vaporisiert
und ionisiert das entstehende Plasma den Analyten.
Die Probe kann direkt oder über kontinuierlichen Fluß iniziert werden.
Vorteile:
schnelle und praktische Molekularmassen Bestimmung
Nachteile:
schwierig für MS/MS -Systeme
benötigt einen Pulsionisations -kompatiblen Detektor
nicht sehr kompatibel mit LC/MS -Systemen
Massen Bereich:
sehr hoch. Typischerweise < 500,000 Da
Trennsystem/Analysensystem: Das Trennsystem (bzw. der
Massenanalysator) Trennt die Ionen nach Ihrem Masse/Ladungs- Verhältnis.
Als Ziel gilt außerdem eine möglichst hohe Auflösung (Unterscheidung möglichst
minimaler Massen) bei gleichzeitig hinreichend durchgelassener Ionenmenge
(erleichterte Detektion).
Dazu wurden eine Vielfalt an Geräten entwickelt.
Magnetsektorfeldgerät:
(kann mit 60°, 90° oder 180° gewinkelt sein)
- Ionen mit kleiner Masse (=> kleinem Momentum) werden am meisten
abgelenkt und kollidieren gleich mit der Röhrenwand.
- Ionen mit hohem Momentum können nicht so leicht vom Weg abgebracht
werden und erleiden das gleiche Schicksal.
- Ionen mit dem richtigen Masse/Ladungs -Verhältnis hingegen können auf
Kurs gehalten werden, passieren den Spalt und kollidieren mit dem Kollektor.
Ein elektrischer Strom ist die Folge, welcher verstärkt und gemessen werden
kann.
Somit können Massenspektren durch Variation der Magnetfeldstärke H, der Beschleunigungsspannung U und des Ablankungsradiuses r aufgenommen werden. (Für gewöhnlich variiert nur eine Größe, aus Konstruktionsgründen sind meist r und U vorgegeben)
Ein Magnetfeld Sektor alleine trennt Ionen nach ihrem Masse/Ladungs
-Verhältnis. Darunter kann aber die Auflösung leiden, denn jene Ionen welche die Ionenquelle verlassen, haben nicht alle denselben Energieinhalt und somit eine unterschiedliche Geschwindigkeit. Das läuft analog zur Optischen Farbverschiebung.
Um Abhilfe zu schaffen hängt man einen elektrischen Sektor an der die Ionen auch nach ihrer kinetischen Energie zu fokussieren.
Diese Geräte nennt man:
Doppelt fokussierende Massenspektrometer: Hier werden die
Fragment-Ionen erst durch ein elektrisches, dann durch ein magnetisches Sektorfeld fokussiert. Im ersten Feld wird gemäß der unterschiedlichen kinetischen Energie fokussiert. Davon abweichende Ionen werden am Ausgangsspalt des Analysators ausgeblendet.
Dadurch können nur noch jene Ionen den Magnetfeldsektor erreichen, deren
kinetische Energie innerhalb eines gewissen (gewünschten) Bereichs liegt.
Vorteile:
sehr hohe Reproduzierbarkeit
Beste quantitative Leistung unter allen MS
hohe Auflösung
hohe Empfindlichkeit
hoher dynamischer Bereich
Nachteile
nicht besonders gut geeignet für Pulsionisationsmethoden
(wie etwa MALDI)
meist voluminöser und teurer als andere Massenanalysatoren
Quadrupol - Massenspektrometer:
Man könnte das Quadrupol - MS als ,Massenfilter' bezeichnen.
Es besteht aus 4 parallel zueinander angeordneten Stabelektroden welche so eingestellt werden können, daß nur Ionen mit einem bestimmten Masse/Ladungs -Verhältnis passieren können.
An jedem sich gegenüberliegenden Paar wird eine Gleichspannung [U] angelegt, die von einer hochfrequenten Wechselspannung [V*coswt] überlagert wird.
Der Ionenstrahl im Inneren des Systems wird nun von dem Hochfrequenzfeld
- massenabhängig - zum Schwingen angeregt. Nur die Schwingungsamplitude von Ionen bestimmter Masse ist klein genug, damit diese auch in den Auffänger gelangen.
Alle weiteren Ionen kollidieren mit den Stäben und werden somit eliminiert.
Werden die Werte für Wechsel- bzw. Gleichspannung geändert, kann das
gesamte Massenspektrum durchfahren werden.
Vorteile:
gute Reproduzierbarkeit
relativ kleine und billige Geräte
Arbeitsdrücke von bis zu 10-2 Pa möglich
Nachteile:
limitierte Auflösung
Peakhöhen/Masse müssen getunt werden
nicht besonders gut für Pulsionisationsmethoden geeignet
Flugzeitmassenspektrometer (TOF -Time Of Flight):
Linear: Ein TOF mißt die massenabhängige Zeit die Ionen brauchen um sich
von er Ionenquelle zum Detektor zu bewegen. Dazu muß die Startzeit (wenn die Ionen die Ionenquelle verlassen) definiert sein.
Am häufigsten werden entweder schnelle Ionisierungstechniken wie Pulsionisation (meist MALDI), oder verschiedene Arten von rasch schaltenden elektrischen
Feldern (als eine Art Tor welches die Ionen von der Quelle geschwind entläßt)
verwendet.
Reflectron: Ionen die eine Ionenquelle eines TOFs verlassen haben weder
die selbe Startzeit noch die selben kinetischen Energien (analog der optischen
Farbverschiebung!). Um diese Unterschiede zu kompensieren wurden viele
verschiedene TOF MS entwickelt.
Ein Reflectron ist eine ionenoptische Einrichtung die analog dem photo- optischen
Spiegel ist. Von Ihr prallen Ionen ab und ihre Flugrichtung wird umgekehrt.
Ein Linearfeld Reflectron erlaubt Ionen höherer Energie es tiefer zu penetrieren als Ionen mit kleinerer Ekin. Deswegen brauchen energetisch höhere Ionen länger um
zum Detektor zu gelangen. Dies führt zu einer höheren Auflösung.
Reflectrons mit einem gekurvten Feld tragen dazu bei, daß die Detektorposition sich nicht mit dem Masse/Ladungs -Verhältnis verschiebt. Auch dies wirkt sich in einer gesteigerten Auflösung aus.
Vorteile:
schnellstes Massenspektrometer
geeignet für Pulsionisierungsmethoden
unbegrenzter Massenbereich
hohe Nachweisempfindlchkeit (es werden keine Spalte benötigt
alle Ionen werden detektiert)
Nachteile:
Pulsionisierung oder Ionenstrahlschaltung von Nöten
Schnelle Digitalisierer können im TOF zu limitierter dynamischer Reichweite führen
Fourier Transform - Massenspektrometer (FT - MS):
Die FT - Massenspektroskopie beruht auf der Ionen Cyclotron Resonanz (ICR). Ionen die mittels e- -Ionisation, Pulsionisation, ESI oder irgend eine andere Weise
produziert wurden werden in einer ICR Zelle aufbewahrt welche sich in einer
homogenen Zone eines großen Magneten befindet.
Die Ionen in dem Feld werden angeregt zyklisch zu oszillieren (A).
Wenn nun die oszillierenden Ionen einem oszillierendem elektrischen Feld ausgesetzt werden (Wechselspannung) welches die selbe Frequenz besitzt, werden die Ionen in einen größeren Radius hinaus beschleunigt. Ionen mit einer
anderen Cyclotronfrequenz werden hingegen nicht beschleunigt (B).
Ohne Kollisionen kreisen die Ionen weiter in einem großen Orbit bei gleicher Geschwindigkeit(C).
FT- MS messen die Spannung die von der Bewegung der Ionen in der ICR
Zelle induziert wird. (siehe Bild)
Wenn die Ionen ( im Bild) sich von der Elektrode 1 entfernen und sich der Elektrode 2 nähern, läßt das elektrische Feld der positiven Ionen Elektronen im externen Schaltkreis durch den Widerstand R fließen und sich in Elektrode 2 sammeln. Auf der anderen Seite des Cyclotronorbits verlassen die e- die
Elektrode 2 und sammeln sich in der Elektrode 1 wenn sich die Ionen nähern.
Der Elektronenfluß im externen Schaltkreis ist ein Wechselstrom welcher der Cyclotronfrequenz der Ionen entspricht, wobei die Amplitude proportional
zur Anzahl der Ionen steht.
Der Elektronenfluß läßt im Widerstand eine kleine AC Strömung entstehen
welche verstärkt und gemessen werden kann.
Es ist also möglich Ionen zu detektieren ohne daß sie mit einer Elektrode kollidieren. Ionenmischungen verschiedener m/z -Verhältnisse werden alle simultan beschleunigt und das gemessene Signal ist eine Mischung aus allen Signalen der Ionen und ihren m/ repräsentierende Frequenzen.
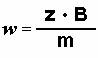
Daraus
läßt sich mit der Formel -
- Ein passendes Massenspektrum errechnen.
w .Cyclotronfrequenz [rad/s]
![]() B .Magnetfeldstärke [Tesla]
B .Magnetfeldstärke [Tesla]
.Masse/Ladungs -Verhältnis der Ionen
Der Druck in einem FT - MS sollte nicht größer als 10-8 mbar (ultrahohes Vakuum) betragen um Interferenzen von Fremdionen oder -Molekülen zu vermeiden und es
wird noch immer an einer Lösung dieses Problems gearbeitet.
Vorteile:
hiermit wurde die bis jetzt höchste Massenauflösung aufgezeichnet
gut geeignet für Pulsionisationsmethoden wie MALDI
Ionen werden nicht zerstört und können nochmals gemessen werden
Stabile Massenkalibrierung möglich (mit Supraleitenden Magneten)
maßgebende Eignung für Ionenchemie und MS/MS Experimente
schnelle Analysen möglich (z.B. Explosionen)
Nachteile:
limitierte dynamische
Reichweite
strenge
Tiefdrucksvoraussetzungen
viele Parameter (Anregung, Trapping, Detektionsbedingungen) beeinträchtigen die Experimentsequenz welche die Qualität des Massenspektrums bestimmt
Quadrupol Ionenfallen:
Ionen werden dynamisch in einem dreidimensionalen Quadrupol Behälter aufbewahrt, dessen RF und DC Potentiale abgetastet werden können um
sukzessive m/z -Verhältnisse in den Ionenfallendetektor zu emittieren.
Die Ionen werden in der Falle erzeugt oder werden von außen injiziert. Sie werden dynamisch von der RF -Spannung (oder von einem ,Gasbad') festgehalten und können analog zur ICR mit RF -Spannungsereignissen dahingehend manipuliert werden um Ioneninjektion, Ionen-anregung und massenselektive Emittierung zu tätigen.
Damit können gleich mehrere MS in Serie geschaltet operiert werden.
Die interionische Ladungsabstoßung schränkt die dynamische Reichweite der Ionenfalle extrem ein. Deswegen wird erst ein Vorscan durchgeführt um den Ionenstrom zu ermitteln. Dann wird der e- -Ionisationsstrom reguliert um
die Ionenanzahl im Arbeitsbereich zu verringern (,Auto-Ranging').
Ionen in der Falle können mit neutralen Molekülen reagieren.
,Self-CI' ist dir Reaktion von Analytionen mit Analytneutralen in der Falle. Dies kann konzentrationsabhängige Veränderungen im Massenspektrum hervorrufen die vermindert werden können indem man Ionen aus einer externen Quelle injiziert
aber dies kann zu einer verminderten Empfindlichkeit führen.
Vorteile:
hohe Empfindlichkeit
mehrstufige MS Kopplungen
kompakter Massenanalysator
Nachteile:
Schlechte Quantitierung
Sehr schlechte dynamische Reichweite
(manchmal mittels Auto-Ranging kompensierbar)
Kollisionsenergie in CID MS/MS nicht besonders gut definiert
viele Parameter (Anregung, Trapping, Detektionsbedingungen)
beeinträchtigen die Experimentsequenz welche die Qualität des Massenspektrums bestimmt
Detektoren: Anfangs wurden zur Umwandlung des Ionenstroms in ein
meßbares Signal Fotoplatten eingesetzt. Heute werden SEV und Faraday-
Detektoren eingesetzt.
Faraday-Detektor:
Die Ladung der Ionen wird (ähnlich dem Detektor bei der FT-MS im ICR) über
einen hochohmigen Widerstand von 109 - 1011 W abgeleitet. Der Spannungsabfall
ist ein Maß für die Intensität der Ionen.
Vorteile:
reproduzierbar
Nachteile:
geringe Empfindlichkeit
sehr hohe Zeitkonstante für Registrierung
(GC/MS -Kopplungen außer Frage)
Interpretation von Massenspektren:
Arten der Angabe von Massenspektren:
Tabellen: Die Intensität [%] wird auf den intensivsten Peak angegeben.
Strichspektren: Das (m/z) -Verhältnis wird direkt proportional zur
relativen Häufigkeit der (Fragment-) Ionen angegeben.
Aus solchen Spektren läßt sich leicht auf den Molekültyp der Probe
schließen. Nehmen wir beispielsweise das Massenspektrum von Wasser:
H2O + e-(schnell) [H2O]+ + 2e-
(Einige e- sind zu schnell und zerstören die Moleküle T Fragment-Ionen!)
Nur gewisse Elementkombinationen besitzen diese Massen. [NH4]+
-Ionen beispielsweise besitzen ebenfalls ~die Masse 18 aber ihre Fragmente ( [N]+ und [NH]+) hätten Peaks bei 14 und 15.
Einige Molekül-Ionen und ihre Stabilität:
Alkohole: Sie verlieren ein Proton und ein Hydroxy Radikal. Außerdem
neigen sie dazu eine der a-Alkylgruppen zu verlieren und Oxonium Ionen zu bilden. Primäre Alkohole erzeugen so einen Peak bei (m/z) = 31,
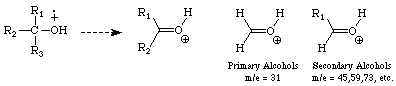
sekundäre
bei (m/z) = 45, 59, 73, etc.
Alkane: - Fragmentieren indem ein CH3 Radikal abgespalten wird (m-15)
Das Karbokation wird nun quer durch die Alkylkette gespalten und setzt neutrales
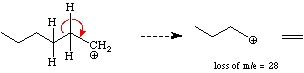
Ethen
frei. Verzweigte Alkane sind stabiler und dominieren das Spektrum.
![]()
Halogenide: Diese Moleküle
fragmentieren indem die
Halogene ausgestoßen werden. Cl und Br weisen mehrere Peaks auf, da
![]()
ihre 2
Isotope relativ häufig sind. (35Cl/37Cl 3,08:1 bzw. 79Br/81Br
b
Säuren, Ester, Amide: Größtenteils wird die ,X' -Gruppe abgespalten und
ein Oxonium Ion wird gebildet. Charakteristische Peaks für Karbonsäuren
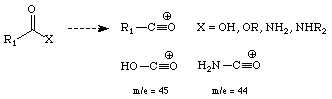
und
unsubstituierte Amide liegen bei (m/z) = 45 und 44.
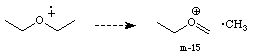
Ether: Wie Alkohole
fragmentieren Ether indem ein Alkyl Radikal
abgespalten wird und sich ein substituiertes Oxonium Ion bildet.
Aldehyde und Ketone: Hier werden vorwiegend Seitenketten abgespalten
Um Oxonium Ionen zu bilden. Diese Bruchstücke sind sehr stabil und deswegen ist dieser Peak der Basispeak. Das Methylderivat CH3C≡O+ wird
![]()
als ,Acyl
Ion' bezeichnet.
Bei Carbonyl- (und auch Nitril-, etc.) Verbindungen wird oft auch das
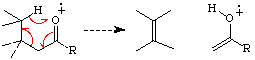
Ausscheiden
von neutralem Ethen beobachtet werden.
Mc Lafferty Umlagerung
Aromatische Kohlenwasserstoffe: Deren Fragmentation läuft
Einigermaßen komplex ab, was die Reihen der Peaks (m/z) = 77, 65, 63, etc. - erklärt. Mit genügend Erfahrung läßt sich diese ,aromatische Gruppe' leicht erkennen. Wenn der Aromat über einen Benzolring verfügt, so erzeugt die
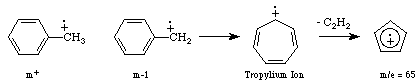
Hauptteilung
ein Benzyl Karbokation welches sich zu einem Tropylium Ion
umlagert und ein Acetylen Molekül (m/z) = 65 abspaltet.
Quellen:
http://chipo.chem.uic.edu/web1/ocol/
http://www.jeol.com
http://www.mpi-muelheim.mpg.de/stoecki/mass_basic.html
http://technology.nasa.gov
http://www.ionspec.com
http://infoseek.go.com
CE ROMPP - Chemie Lexikon
http://www.ims.uconn.edu/~lavigne/gcmslab.html
Anmerkung:
Der Korrektheit wegen: Viele Begriffe mußten erst aus dem Englischen übersetzt werden. Somit kann ich leider nicht für ihre Richtigkeit garantieren. Ich danke für Euer Verständnis!
Haupt | Fügen Sie Referat | Kontakt | Impressum | Nutzungsbedingungen
