Verbrennungstechnik
Brennstoffe
Heizwert
Oberer Heizwert
Unterer Heizwert
Verbrennungsvorgang
Verbrennungsgleichungen
Ermittlung von Sauerstoff-, Luftbedarf u. Rauchgasmenge
Verbrennungskontrolle
Verbrennungsdreiecke
BUNTE - Dreieck
Ostwald - Dreieck
Enthalpie - Temperatur - Diagramm
Brennstoffe
Im Brennstoff ist Energie chemisch gebunden, die durch die Verbrennung, d.h. durch Reaktion mit Sauerstoff frei wird. Diese Energie wird vielseitig ausgenutzt (z.B. für die Dampferzwugung, Heizungen usw.)
Man unterscheidet zwischen:
feste Brennstoffe (z.B. Holz, Kohle)
flüssige Brennstoffe (z.B. Heizöl)
gasförmige Brennstoffe (z.B. Erdgas, Hochofengas)
Der Brennstoff besteht grundsätzlich aus:
a.) brennbaren Bestandteil b.) Ballaststoffe
Kohlenstoff C Asche
Wasserstoff H2 Stickstoff N2
Sauerstoff O2
Bei festen und flüssigen Brennstoffen werden die Mengen der vorhandenen Elemente durch eine Analyse bestimmt und als Massenanteile (Massenprozente) angegeben.
Die Summe der Massenanteile muss 100% ergeben.
C + s + h + a + w + n + o = 1 (Kleinbuchstaben stehen für Massenanteile)
Bei Brenngasen wird keine Elementaranalyse sondern eine Analyse der Raumanteile (Vol%) der Einzelgase durchgeführt. Die Summe muss wieder 100% ergeben.
CO2b + COb + H2b + CH4b + C2H4b + C2H6b + CnHmb + N2b + O2b = 1
![]()
![]()
Athen (Athylen) Athan
Wenn wir diese Gase als ideal ansehen, so sind die Raumteile gleichzeitig "Mol" - Anteile. Im Brenngas vorhandenes H2O wird nicht als Raumanteil, sondern durch Angabe der relativen Gasfeuchte G berücksichtigt.
Heizwert
Die im Brennstoff gebundene Energie wird durch den Heizwert gekennzeichnet.
Man unterscheidet dabei:
oberer Heizwert HO
unterer Heizwert HU
Als Heizwert bezeichnet man jene Wärmemenge, welche bei vollständiger und vollkommener Verbrennung von 1 kg (bei Gasen 1 m³) Brennstoff frei wird.
Der Unterschied zwischen HO und HU liegt darin, dass bei HO die Kondensationswärme des bei der Verbrennung entstandenen Wasserdampfes mit eingerechnet wird, d.h. der Wasserdampf muss kondensiert sein.
Bei HU wird die Kondensationswärme nicht berücksichtigt. Im Kesselbetrieb hat im allgemeinen nur HU praktisch Bedeutung, da in den meisten Fällen die Kondensationswärme des Wasserdampfes nicht nutzbar gemacht werden kann.
HU = HO - w * r w... Wasseranteil
r..Verdampfungswärme
Auf die Masse bezogen:
HU, HO ![]()
Auf die Molmasse bezogen:
HUm, HOm ![]() HUm
= HU*M =
HUm
= HU*M = ![]()
![]() =
= ![]()
Für Gase:
HUm = HUN * Vmn ![]()
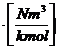 =
= ![]()
Der Heizwert kann auf zwei Arten ermittelt werden:
Experimentell, d.h. durch Bombenkalorimeter
Rechnerisch mit empirischen Formeln (z.B. nach W. Boie)
Verbrennungsvorgang
Kohlenstoff, Wasserstoff und Schwefel, bilden gasförmige Verbrennungsprodukte. Reagieren diese Stoffe zu den Endprodukten CO2, H2O und SO2, so wird die Verbrennung als vollständig bezeichnet.
Treten jedoch nach der Verbrennung noch brennbare Gase wie CO, H2 und CH4 oder feste brennbare Stoffe auf, so ist die Verbrennung unvollständig.
Für eine vollständige Verbrennung müssen folgende drei Bedingungen erfüllt sein:
erforderlicher Sauerstoff muss vorhanden sein
Er wird meist der Umgebungsluft entnommen. In besonderen Fällen wird auch reiner Sauerstoff verwendet, wie beispielsweise beim Schweißen zum Erzielen hoher Temperaturen.
Zündtemperatur muss erreicht sein
Man versteht darunter die Temperatur, bei der die Verbrennung so schnell verläuft, dass sie unter starker Wärmeabgabe sich selbst aufrecht erhält.
Zündgrenzen müssen eingehalten werden
Dies ist bei Gasen und Dämpfen wichtig, d.h. es muss die Mischung des Gases mit dem Sauerstoff oder Verbrennungsluft örtlich stimmen. Diese sind dadurch begründet, dass die bei der Reaktion des Gases mit dem Sauerstoff frei werdende Wärme ausreichen muss, um eine Mindesttemperatur aufrecht zu erhalten. Das ist durch eine kleine Luftmenge in einer großen Gasmenge nicht möglich, da dann nur ein kleiner Teil des Brenngases reagieren kann, also nur wenig Energie frei wird.
Aber auch eine kleine Gasmenge in einer großen Luftmenge liegt außerhalb der Zündgrenzen, da durch die kleine Gasmenge die große Gemischmenge nicht auf der notwendigen Mindesttemperatur gehalten werden kann.
3.1 Verbrennungsgleichungen
C + O2 = CO2
C + ½ O2 = CO
CO + ½ O2 = CO2
H2 + ½ O2 = H2O
S + O2 = SO2
Ermittlung von Sauerstoff,- Luftbedarf und Rauchgasmenge
Man ermittelt zuerst für die an der Verbrennung beteiligten Elemente mit Hilfe der Verbrennungsgleichungen die benötigte Sauerstoffmenge. Daraus ergibt sich über den Sauerstoffanteil der Luft die erforderliche Verbrennungsluftmenge.
Für feste und flüssige Brennstoffe gilt:
Kohlendioxid:
C + O2 = CO2
![]() 1
1 ![]() C + 1
C + 1 ![]() O2 = 1
O2 = 1 ![]() CO2
CO2
Blick ins PSE nach Molmasse
![]() 12
12 ![]() + 2 * 16
+ 2 * 16 ![]() = 44
= 44 ![]() CO2
CO2
/ : 12 (um auf 1 kg C zu beziehen)
1 ![]() C +
C + ![]()
![]() O2 =
O2 = ![]()
![]() CO2
CO2
für 1 kg Brennstoff erforderliche Sauerstoffmenge
in ![]() :
:
c * ![]()
![]() O2
O2 ![]() (für 12 kg C
brauche ich 32 kg O2)
(für 12 kg C
brauche ich 32 kg O2)
(für 1 kg C brauche ich 32/12 kg O2)
(für c kg C brauche ich c* 32/12 kg O2)
in ![]() :
:
c* ![]()
![]() O2 ( für 12 kg C brauche ich 1 kmol O2)
O2 ( für 12 kg C brauche ich 1 kmol O2)
(für 1 kg C brauche ich 1/12 kmol O2)
(für c kg brauche ich c* 1/12 kmol O2)
in ![]() :
:
c* 1.86 ![]() O2 m= * V V=
O2 m= * V V= ![]() =
= ![]() = 1.86
= 1.86 ![]()
Wasser:
H2 + ½ O2 = H2O
1 ![]() H2 + ½
H2 + ½ ![]() O2 = 1
O2 = 1 ![]() H2O
H2O
2 ![]() H2 + 16
H2 + 16 ![]() O2 = 18
O2 = 18 ![]() H2O
H2O
1 ![]() H2 + 8
H2 + 8 ![]() O2 = 9
O2 = 9 ![]() H2O
H2O
für 1 kg Brennstoff erforderliche Sauerstoffmenge:
in ![]() :
:
h* 8 ![]() O2
O2
in ![]() :
:
h* ![]()
![]() O2 (für 2 kg H brauche ich ½
kmol O2)
O2 (für 2 kg H brauche ich ½
kmol O2)
(für 1 kg H brauche ich ¼ kmol O2)
(für
h kg H brauche ich h* ![]() kmol O2)
kmol O2)
in ![]() :
:
h*5.63 ![]() O2 V=
O2 V= ![]() =
= ![]() = 5.63
= 5.63 ![]()
Schwefeldioxid:
S + O2 = SO2
1 ![]() S + 1
S + 1 ![]() O2 = 1
O2 = 1 ![]() SO2
SO2
32 ![]() S + 32
S + 32 ![]() O2 = 64
O2 = 64 ![]() SO2
SO2
1 ![]() S + 1
S + 1 ![]() O2 = 2
O2 = 2 ![]() SO2
SO2
für 1 kg Brennstoff erforderliche Sauerstoffmenge:
in ![]() :
:
s* 1 ![]() O2
O2
in ![]() :
:
s* ![]()
![]() O2
O2
in ![]() :
:
s* 0.7 ![]() O2
O2
Der gesamte benötigte Sauerstoffbedarf:
![]() Das ist bereits im Brennstoff enthalten und
brauche es nicht mehr zuführen!
Das ist bereits im Brennstoff enthalten und
brauche es nicht mehr zuführen!
O2 ![]() =
= ![]() * c + 8 * h + 1 * s - 1 *o
* c + 8 * h + 1 * s - 1 *o
O2 ![]() =
= ![]() * c +
* c + ![]() * h +
* h + ![]() *s -
*s - ![]() * o
* o
O2 ![]() = 1,86 * c + 5,6 * h +
0,7 * s - 0,7 * o
= 1,86 * c + 5,6 * h +
0,7 * s - 0,7 * o
Bestandteile der Luft:
Für eine einfachere Berechnung wird der
Edelgasanteil zum Stickstoffanteil dazugerechnet,
d.h. Stickstoffanteil = 79 Vol%
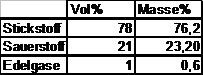
Die zur Verbrennung benötigte Mindestluftmenge (trocken):
Lmintr = ![]() =
= ![]()
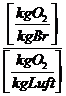
![]()
![]()
Lmintr = ![]() =
= ![]()
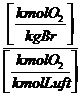 (da wir das Gas
als ideal ansehen, sind die Raumanteile (Vol%) gleich Mol-Anteile)
(da wir das Gas
als ideal ansehen, sind die Raumanteile (Vol%) gleich Mol-Anteile)
Lmintr = 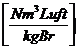 =
= ![]()
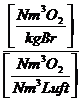
Mit Berücksichtigung des Wasserdampfgehaltes in der Luft (Luftfeuchtigkeit):
lminf = lmintr + wL * lmintr = (1-wL)*lmintr
wL = Luftfeuchte
wL = ![]() =
= ![]() pD = Teildruck des
Wasserdampfes
pD = Teildruck des
Wasserdampfes
pL = Teildruck der trockenen Luft
p = Gesamtdruck
pD = * pS = relative Luftfeuchtigkeit
= ![]()
pS = Sättigungsdruck des Wasserdampfes
wL = ![]()
![]()
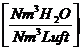
wL = 0,62* 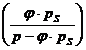
![]() Wie kommt man zu 0,62?
Wie kommt man zu 0,62?
=
![]() =
= ![]() = 0,62
= 0,62
tatsächliche Luftmenge:
ltats = * l minf = Luftüberschusszahl
Rauchgasmenge:
Kohlendioxid CO2:
in ![]() :
:
c * ![]()
![]()
in ![]() :
:
c * ![]()
![]()
in ![]() :
:
c * 1,86 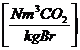
Schwefeldioxid SO2 :
in ![]() :
:
s * 2 ![]()
in ![]() :
:
s * ![]()
![]()
in ![]() :
:
s * 0,7 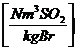
Wasser H2O :
in ![]() :
:
Das ist schon im Das wird durch die Verbrennungsluft
Brennstoff vorhanden zugeführt!
![]()
![]()
9 * h + w + wL * * lmin
![]() w = Wasseranteil im
Brennstoff (liegt flüssig vor)
w = Wasseranteil im
Brennstoff (liegt flüssig vor)
in ![]() :
:
![]() * h +
* h +![]() + wL * * lmin
+ wL * * lmin ![]()
in ![]() :
:

![]() =
= ![]()
![]() =1,24
=1,24
11,2 * h + 1,24 * w + wL * lmin * 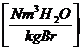
Stickstoff N2 :
in ![]() :
:
Das führe ich durch die Verbrennungsluft zu
![]() Im
Brennstoff vorhanden
Im
Brennstoff vorhanden
![]()
n + 0,762 * * lmin ![]()
in ![]() :
:
![]() + 0,79 * * lmin
+ 0,79 * * lmin ![]()
in ![]() :
:
n * 0,8 + 0,79 * * lmin 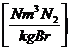
![]() =
= ![]() = 0,8
= 0,8
Sauerstoff O2:
in ![]() :
:
0,23 * ( - 1) * lmin ![]()
in ![]() :
:
0,21 * ( - 1) * lmin ![]()
in ![]() :
:
0,21 * ( - 1) * lmin 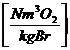
Man unterscheidet :
trockene min. RG - Menge
feuchte min. RG - Menge
trockene tats. RG - Menge
feuchte tats. RG - Menge
zu 1. :
Vtro min = VCO2 + VSO2 + VN2
= 1,86 * c + 0,7 * s + 0,8 * n + 0,79 * lmin 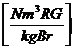
zu 2. :
V f
min = Vtr min + 11,2 * h + 1,24 * w + wL * lmin
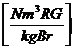
zu 3. :
Vtr tats = VCO2 + VSO2 + VN2 +VO2
= 1,86 * c + 0,7 * s + 0,8 * n + 0,79 * * lmin
+ 0,21 * ( - 1) * lmin 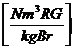
zu 4. :
V ftat
= V trtat + 11,2 * h +1,24 * w + wL * *
lmin 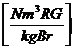
Verbrennungskontrolle
Um die Güte der Verbrennung zu überprüfen, müssen das Luftverhältnis l, eventuell vorhandene brennbare Abgasbestandteile, sowie die festen Rückstände ermittelt werden. Eine unmittelbare Luftmengenmessung ist ungenau, da eventuell falsch angesaugte Luft nicht berücksichtigt werden kann. Auch die exakte Messung der Abgasmenge ist kaum möglich. Das Luftverhältnis und die auf die Brennstoffmenge bezogene Abgasmenge können aber aus der Abgaszusammensetzung berechnet werden. Die Abgasanalyse gibt somit genau Auskunft darüber, ob die Verbrennung richtig ausgeführt wird.
Abgasanalyse:
Chemische Verfahren (Orsatgerät)
Physikalisches Verfahren (z.B. auf Infrarotabsorptionsbasis)
Auswertung der Messung:
Stoffbilanzen: Alle Stoffe die der Feuerung zugeführt werden, müssen sie auch wieder verlassen.
![]()
![]()
 Brennstoff Feuchtes Gas
Brennstoff Feuchtes Gas
C,h,s,w,n,o,a CO2, SO2, H2O, CO, CH4, H2, N2, O2
![]()
![]() O2, N2, H2O Asche
und Unverbranntes
O2, N2, H2O Asche
und Unverbranntes
Feuchte Verbrennungsluft
Ermittlung der Abgasmenge aus der Kohlenstoffbilanz:
![]()
![]() Durch Brennstoff zugeführt Gesamtes hinter "=" ist nach der
Verbrennung im Rauchgas
Durch Brennstoff zugeführt Gesamtes hinter "=" ist nach der
Verbrennung im Rauchgas
![]()
![]()
![]() = Vtr
= Vtr ![]() * (CO2 + CO + CH4)
* (CO2 + CO + CH4) ![]() +
+ ![]()
![]() Vtr
Vtr
c - ![]() = * c =
vergaster Kohlenstoff
= * c =
vergaster Kohlenstoff
Vtr = 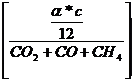
Feuchte Abgasmenge:
Vf = Vtr + VH2O
Stickstoffbilanz:
Durch Verbrennungsluft zugeführt
![]()
![]()
![]()
![]() + 0,79 * * lmin = Vtr * N2
Vtr =
+ 0,79 * * lmin = Vtr * N2
Vtr = 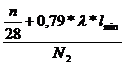
Durch Brennstoff zugeführt Durch Abgas abgeführt
erhält man nun durch gleichsetzen von Vtr Stickstoff und Vtr Kohlenstoff:
![]()
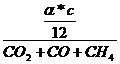 =
= 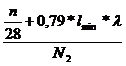
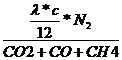 =
= ![]()
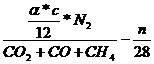 =
= ![]()
![]()
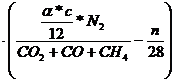
= ![]()
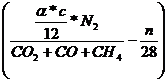
6. Verbrennungsdreiecke
Verbrennungsdreiecke veranschaulichen den Zusammenhang zwischen dem CO2-, O2- und CO- Gehalt des Abgases und ermöglichen die graphische Ermittlung des Luftverhältnisses.
Man unterscheidet zwischen:
6.1 Bunte-Dreieck
6.2 Ostwald Dreieck
Das Ostwald - Dreieck gilt nur für einen bestimmten Brennstoff und Verbrennung ohne feste Rückstände, jedoch wird die vollständige Verbrennung des Kohlenstoffes erfaßt. Mit dem Ostwald - Dreieck kann das Luftverhältnis graphisch ermittelt und die Richtigkeit der Abgasanalyse kontrolliert werden, da durch Bestimmung zweier Abgasanteile der dritte vorliegt.
Enthalpie - Temperatur - Diagramm
Für genauere wärmetechnischen Berechnungen wird für den jeweiligen Brennstoff ein H -t -Diagramm erstellt. Der Wärmeinhalt des Rauchgases kann dabei entweder auf 1 m³ Rauchgas oder auf 1 kg Brennstoff bezogen sein. Die Bezugsart aud 1 kg hat den Vorteil, dass der Heizwert unabhängig von der Luftüberschusszahl l als horizontale Gerade festliegt. Ferner ist es günstig, als Bezugstemperatur nicht 0°C, sondern Umgebungs- bzw. Kesselhaustemperatur anzunehmen, da dann eventuell einströmende Falschluft Wärme mitbringt.
Zur Berechnung des Diagramms ist die Kenntnis der spezifischen Wärme der Rauchgasbestandteile nötig. Da die spezifische Wärme von der Temperatur abhängig ist, rechnet man mit einem Mittelwert cpm, welcher die mittlere spezifische Wärme zwischen den Temperaturen 0 und t [°C] darstellt und aus Tabellen entnommen wird. Den Wärmeinhalt des gesamten Rauchgases bei t [°C] erhält man durch Addition der Wärmeinhalte aller Rauchgasanteile. Mit steigendem l wird die Kurve steiler, da die Rauchgasmenge pro kg Brennstoff mit höherem l steigt. Über 1500°C muss vor allem die Aufspaltung von CO2, H2O berücksichtigt werden, da vom Rauchgas zusätzlich Wärme aufgenommen wird, was wiederum einen steileren Anstieg der H- t- Kurve zur Folge hat.
Der auf 1 kg Brennstoff bezogene Wärmeinhalt eines Rauchgasanteiles beträgt bei t [°C]:
H.. = cpm.. * V..* t ![]()
z.B. für CO2
HCO2 = cpm, CO2 * VCO2*t
Haupt | Fügen Sie Referat | Kontakt | Impressum | Nutzungsbedingungen
