Def.:
Säure und ihrer konjugierten Base bestehen (Stoffmengenverhältnis 1:1).
Sie sind in der Lage den pH-Wert innerhalb gewisser Grenzen ungefähr
konstant zu halten, selbst nach Zugabe von kleinen Mengen einer Säure oder Base.
Funktionsweise:
Die zugegebenen Protonen reagieren mit der Pufferbase zu der schwachen
Säure und die zugegebenen Hydroxidionen mit der Puffersäure zu der
konjugierten Base und Wasser. An den Konzentrationen der Puffersäure
bzw. -base ändert sich nicht viel, wenn die zugegebenen Stoffmengen nicht
allzu groß sind, deshalb bleibt der pH-Wert nahezu konstant.
Rechnerisch läßt sich das anhand der Henderson-Hasselbalch-Gleichung
belegen:
pH= pKs - log [c (Puffersäure) / c (Pufferbase)]
Den Bereich in dem der Puffer effektiv wirkt, nennt man Pufferbereich.
Dieser liegt gewöhnlich 1 pH-Einheit über oder unter dem pKs der Säure.
( pH = pKs + oder - 1)
In der Titrationskurve ist er als eben verlaufender, mittlerer Teil (m fast 0) zu
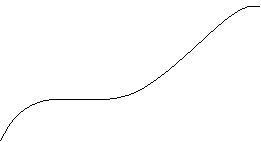
![]() erkennen:
erkennen:
pH
![]()
![]()
![]()
![]()
![]()
![]() pH = pKs
pH = pKs
V Base in ml
kann, ohne das sich der pH-Wert wesentlich ändert bezeichnet man als Puffer-
kapazität. Diese ist abhängig von der Menge der vorgelegten Puffersäure bzw.
-base.
Besonders wichtig sind Puffersysteme für den lebenden Organismus. Das menschliche Blut ist sehr gut gepuffert durch die Systeme H²CO³/NaHCO³
und NaH²PO²+²/Na²HPO²+². Deshalb besitzt es einen nahezu konstanten
pH-Wert von 7,4.
Haupt | Fügen Sie Referat | Kontakt | Impressum | Nutzungsbedingungen
