Die 3 wichtigsten Hydroxide

Merksatz:
![]() Metallhydroxid
+H2O positiv
geladene + einfach negativ geladene
Metallhydroxid
+H2O positiv
geladene + einfach negativ geladene
Metall- Ion Hydroxid- Ion
![]() (unedle Metalle)
(unedle Metalle)
lassen sich mit Indikatoren nachweisen
Unitest wird blau
Lachmus wird blau
Phenolphthalein wird rot- violett
![]() z.B. NaOH H2O Na+
+ OH-
z.B. NaOH H2O Na+
+ OH-
Exp.
- evl.
Entstandene Gase entzünden
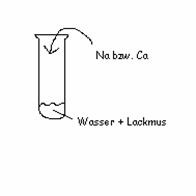
Beobachtung: - Das Wasser + Lackmus- gemisch färbt sich blau- violett
Darstellung von Hydroxiden
- Entstehung von brennbaren Gasen
![]()
![]() Auswertung: Ca + 2H2O H2 + Ca(OH)2
Auswertung: Ca + 2H2O H2 + Ca(OH)2
![]()
![]()
![]()
![]()
![]()
![]() 2Na + H2O H2 + NaOH
2Na + H2O H2 + NaOH
brennbares Gas färbt Lackmus blau
![]() unedles Metall + Wasser Wasserstoff + Metallhydroxid
unedles Metall + Wasser Wasserstoff + Metallhydroxid
Esp.
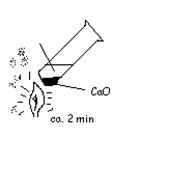
mit
Lackmus prüfen
filtrieren
mit Trinkrörchen vorsichtig ins Filtrat pusten
Beobachtung: - ein teil des Ca löst sich auf
- Unitest wurde blau
- beim hineinpusten wurde die Lösung trüb
![]()
![]() CaO + H2O Ca(OH)2
CaO + H2O Ca(OH)2
![]() (Brandkalk) (Löschkalk) enthält Hydroxid-
Ionen färbt Unitest blau
(Brandkalk) (Löschkalk) enthält Hydroxid-
Ionen färbt Unitest blau
+H2O = Kalklöschen
![]() Metalloxid + Wasser Metallhydroxid
Metalloxid + Wasser Metallhydroxid
Zu Atemluft in Ca(OH)2:
![]() CO2
(Luft) + H2O H2Ca3
CO2
(Luft) + H2O H2Ca3
![]() H2CO3 +H2O 2H+ + CO32-
H2CO3 +H2O 2H+ + CO32-
![]()
![]()

![]()
![]() 2H+
+ CO32- + Ca2+ + 2OH- 2H2O + CaCO3
2H+
+ CO32- + Ca2+ + 2OH- 2H2O + CaCO3
![]()
Kohlensäure Kalziumhydroxid entstandenes ist nicht H2O- lösl.
![]()
![]() weiße
Trübung, (Niederschlag)
weiße
Trübung, (Niederschlag)
weil nicht Wasser- lösl.
Märksätze:
Chemische Reaktionen, bei denen in einer Lösung Ionen zu einen schwer löslichen Feststoff (als Niederschlag erkennbar) zusammentreten, heißen
FALLUNGSREAKTIONEN
![]()
![]() z.B. Ca2- + Co2-3 CaCo3
z.B. Ca2- + Co2-3 CaCo3
![]()
![]()
in Lösung
Chemische Reaktionen, bei denen positiv geladene Wasserstoff- Ionen und negativ geladene Hydroxid- Ionen zu neutralen Wassermolekülen zusammenquellen heißen
NEUTRALISATIONEN
![]() z.B. H+ + OH- H2O
z.B. H+ + OH- H2O
(aus Säure) (aus Lauge)
Haupt | Fügen Sie Referat | Kontakt | Impressum | Nutzungsbedingungen
