Brennstoffzellen
Bereits
im Jahre 1839 wurde der Grundstein für die heutige Brennstoffzellentechnik
gelegt.
Der wallisische Jurist und Physiker Sir William Robert Grove (1811-1896) war
es, der den ersten funktionsfähigen Prototypen konstruierte. Dieser bestand aus
zwei Platin-Elektroden, die jeweils von einem Glaszylinder umschlossen waren.
In dem einen Glaszylinder befand sich Wasserstoff, in dem anderen Sauerstoff.
Beide Elektroden tauchten in verdünnte Schwefelsäure ein, die als Elektrolyt
diente und die elektrische Verbindung schuf. An den Elektroden konnte eine
Spannung abgegriffen werden. Da diese sehr gering war, schaltete Grove mehrere
dieser Brennstoffzellen zusammen, um eine höhere Spannung zu erhalten.
Groves Zeitgenossen verkannten seine Entdeckung, und das Thema Brennstoffzelle
geriet in Vergessenheit. Erst in den 1950er Jahren, im Zeichen des kalten
Krieges, wurde seine Idee wieder aufgegriffen. In der Raumfahrt und in der
Militärtechnik wurden kompakte und leistungsfähige Energiequellen benötigt.
In
Raumfahrzeugen und U-Booten gibt es Bedarf an elektrischer Energie, ohne dass
Verbrennungsmotoren eingesetzt werden können. Da Batterien für Raumfahrzeuge zu
schwer sind, entschied sich die NASA (z.B. im Apollo Programm) für die direkte
chemische Energieerzeugung durch Brennstoffzellen.
Die Zivile Nutzung der Brennstoffzelle wurde erst in den letzten Jahren
interessant.
Wissenschaftler
und Ingenieure entwickelten zu Beginn der 90er Jahre verschiedene neue Konzepte
und Technologien, mit denen es gelang, die Leistungsfähigkeit kontinuierlich zu
steigern und gleichzeitig die Kosten zu senken.
Inzwischen reichen die Einsatzmöglichkeiten von Fahrzeugantrieben,
Hausheizungen und Großkraftwerken mit mehreren Megawatt Leistung, bis in den
Bereich der Kleinstanwendungen wie Handys oder mobile Computer hinein.
Die
Brennstoffzelle könnte die Welt der Energietechnik revolutionieren!
|
Brennstoffzellen
sind sehr einfach aufgebaut. Die eigentliche Zelle besteht aus drei
übereinander liegenden Schichten:
Die erste Schicht ist die Anode, die zweite ein Elektrolyt und die dritte
Schichte bildet die Kathode. Anode und Kathode dienen als Katalysator. Die
mittlere Schicht besteht aus einer Trägerstruktur, die den Elektrolyten in
sich aufnimmt. Als Elektrolyten dienen in den verschiedenen
Brennstoffzellentypen jeweils unterschiedliche Stoffe. Manche Elektrolyten
sind flüssig, andere sind fest und haben eine Membran-Struktur.
Da
eine einzelne Zelle nur eine sehr geringe Spannung erzeugt, werden je nach
benötigter Spannung einzelne Zellen aufeinander gestapelt. Solch ein Stapel
nennt sich 'Stack'.
|
|
Die Brennstoffzelle kehrt den Prozess der aus dem
Schulunterricht bekannte Elektrolyse um. Erinnern wir uns: bei der
Elektrolyse wird Wasser mit Hilfe elektrischer Energie in die gasförmigen
Bestandteile Wasserstoff und Sauerstoff zerlegt.
Die Brennstoffzelle nimmt genau diese beiden Stoffe und
verwandelt sie wieder in Wasser. Dabei wird theoretisch die Menge
elektrischer Energie wieder abgegeben, die bei der Elektrolyse zur Spaltung
notwendig war. In der Praxis führen verschiedene physikalisch-chemische Prozesse
zu geringfügigen Verlusten.
Man kann also sagen, die elektrische Energie wird im
Wasserstoff gespeichert. Mit dem Wasserstoff haben wir also ein Gas, in dem
wir elektrische Energie speichern können, und mit der Brennstoffzelle
produzieren wir daraus wieder elektrischen Strom. Die meisten
Brennstoffzellen funktionieren mit Luft, so dass der Sauerstoff nicht
gespeichert werden muß.
Es gibt verschiedene Brennstoffzellen-Typen , die sich in
Aufbau und Funktionsweise unterscheiden. Exemplarisch soll anhand einer
PEM-Brennstoffzelle das grundlegende Arbeitsprinzip beschrieben werden:
Befindet sich an der Anode Wasserstoff und an der Kathode Sauerstoff, läuft
folgender Vorgang ab: Ein Wasserstoffmolekül wird unter Abgabe von
Elektronen in zwei Wasserstoffatome gespalten. Die entstehendenen
Wasserstoff-Ionen wandern durch den für sie durchlässigen Elektrolyten zur
Kathode und oxidieren mit Sauerstoff zu Wasser. Damit Wasser entstehen
kann, werden die Elektronen benötigt, die vorher an der Anode abgegeben wurden.
Der Elektolyt stellt aber einen Isolator dar, durch den sich die Elektronen
nicht bewegen können. Verbindet man nun die beiden Elektroden mit einem
elektrischen Leiter, so wandern die Elektronen durch diesen von der Anode
zur Kathode: es fließt ein nutzbarer, elektrischer Strom.
Dieser Prozess läuft kontinuierlich ab solange
ausreichend Wasserstoff und Sauerstoff an Anode und Kathode zur Verfügung
stehen.
|
|
|
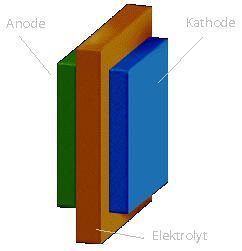
Prinzipbild einer Zelle

|
|
Prinzipbild eines Stacks. Die Bipolarplatte (dunkelblau) trennt die
einzelnen Zellen elektrisch voneinander. Ein Stack ist eine Reihenschaltung
einzelner Zellen.
|
|
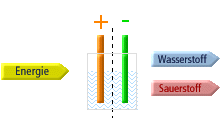
Prinzip der Elektrolyse
|
|

Prinzip der Brennstoffzelle
|
|
|
|
