ELEKTROLYSE UND GALVANISCHE ELEMENTE
1 Redox-Reaktionen nutzbar gemacht - galvanische Zellen
Naturwissenschaftler bemühen sich, Zusammenhänge und Gesetzmäßigkeiten in Naturerscheinungen zu entdecken und zu beschreiben. Auf ihren Ergebnissen aufbauend können dann Techniker Verfahren entwickeln und Geräte bauen, in denen die wissenschaftlichen Erkenntnisse praktische Anwendung finden.
Interessante Beispiele für diese Zusammenarbeit zwischen Wissenschaft und Technik findet man in der Entwicklung moderner Batterien und anderer Stromversorgungsgeräte. Hier haben Wissenschaftler gezeigt, auf welche Weise es grundsätzlich möglich ist, elektrische Energie aus chemischen Vorgängen zu gewinnen.
1.1 Galvanische Zellen
Taucht man ein Zinkblech in eine wässrige Lösung von Kupfersulfat, so gehen Elektronen von der Oberfläche des Zinkblechs auf die Kupfer-Ionen über. Zink wird oxidiert, Kupfer-Ionen werden reduziert. Lasst man beide Teilreaktionen räumlich getrennt ablaufen, so lässt sich der Elektronenfluss technisch nutzen. Dies geschieht in einer galvanischen Zelle.
Um eine solche Zelle aufzubauen, stellt man ein Zinkblech in eine Zinksalz-Lösung und ein Kupferblech in eine Kupfersulfat-Lösung. Beide Halbzellen sind durch eine poröse Wand, das Diaphragma, getrennt. Zwischen dem Zinkblech und dem Kupferblech besteht eine Potentialdifferenz (Spannung).
Verbindet man die beiden Metalle durch einen Draht miteinander, so fließt ein Strom, mit dem ein kleiner Motor betrieben werden kann. Das Zink bildet bei dieser Anordnung den Minuspol. Elektronen fließen vom Zink zum Kupferblech, dem Pluspol. An der Metalloberfläche werden die Kupfer-Ionen der Salzlösung zu metallischem Kupfer reduziert. In der Zink-Halbzelle gehen Zink-Ionen in Lösung. Es laufen also folgende Halbzellen-Reaktionen ab.
Minuspol Zn Zn2+ 2 e-
Pluspol: Cu2+ + 2e- → Cu
Eine galvanische Zelle besteht aus zwei verschiedenen Halbzellen, die
elektrisch leitend miteinander verbunden sind.
Mit dem Standard- Elektrodenpotential wird das Redoxverhalten eines Redoxpaares Men+/Me quantitativ erfasst. Man hat sich darauf geeinigt, zur Bestimmung von Standard- Elektrodenpotentialen die Wasserstoffhalbzelle als Bezugshalbzelle zu verwenden. In einer Galvanischen Zelle wird die Wasserstoffhalbzelle mit einer Halbzelle kombiniert. Das gemessene Potential nennt man Standard-Elektrodenpotential. Je kleiner das Redoxpotential ist, desto größer ist die Reduktionswirkung des Metalls und desto schwächer, die Oxidationswirkung des Metall-Ions. Unedle Metalle sind daher durch ein negatives, edle durch ein positives Standard- Elektrodenpotential gekennzeichnet.
Ahnlich wie bei der Wasserstoffhalbzelle lassen sich Halbzellen mit nichtmetallischen Redoxpaaren aufbauen und so auch deren Standard-Elektrodenpotentiale bestimmen.
Ordnet man alle Redoxpaare nach ihren Standard- Elektrodenpotentialen, erhält man die so genannte Spannungsreihe.
Die Spannungsreihe liefert wichtige Informationen über den Verlauf von Redoxreaktionen in wässriger Lösung, da hier die Reduktions- bzw. die Oxidationswirkung der Redoxpaare erfasst wird. Je kleiner das Standard- Elektrodenpotential ist, desto stärker reduzierend wirkt das Redoxsystem.
Auch die Elektroden können als Oxidations- bzw. Reduktionsmittel angesehen werden, da sie Elektronen abgeben bzw. aufnehmen.
Die Anode ist so das stärkste Oxidationsmittel, die Katode das stärkste Reduktionsmittel.
|
oxidierte Form |
reduzierte Form |
U/V |
|
Li+(aq) + e- |
Li(s) |
|
|
Na+(aq) + e- |
Na(s) |
|
|
Al3+(aq) + 3e- |
Al(s) |
|
|
Zn2+(aq) + 2e- |
Zn(s) |
|
|
222222222Sn2+(aq) + 2e- |
Sn(s) |
|
|
Pb2+(aq) + 2e- |
Pb(s) |
|
|
Cu2+ + e- |
Cu+(s) |
|
|
Ag+(aq) + e- |
Ag(s) |
|
Spannungsreihe. Standard- Elektrodenpotentiale U einiger Redoxpaare
1.2 Elektrodenpotentiale und Reaktionsverhalten
Verhalten von Metallen gegenüber sauren Lösungen
Unedle Metalle haben ein negatives Standard- Elektrodenpotential. Sie lösen sich in saurer Lösung unter Wasserstoffentwicklung:
2 Me(s) + 2 n H+(aq) ---> 2 Men+ + (aq) + n H2(g) Edelmetalle haben ein positives Redoxpotential. Sie lassen sich nicht von Hydronium-Ionen oxidieren. So reagiert Kupfer nicht mit verdünnter Salpetersäure.
Königswasser
Wegen ihres höheren Redoxpotentials werden Gold und Platin von Salpetersäure nicht angegriffen. Diese Metalle lösen sich aber in Königswasser, einem Gemisch aus einem Teil konzentrierter Salpetersäure und drei Teilen konzentrierter Salzsäure. Es läuft folgende Redoxreaktion ab:
HNO3(aq) + 3 HCl(aq) --> NOCI(aq) + Cl2(g) + 2 H2O(l)
Neben Nitrosylchlorid liegt freies Chlor vor, dass die Metalle unter Bildung von Chloro-Komplexen ([AuCl4]-, [PtCl6]2- ) oxidiert:
Au(s) + 4 CI-(aq) --> [AuC14] (aq) + 3e- U= 1,00 V
aq . . . in Wasser gelöst (aquatisiert) g . . . gasförmig (gas) l . . . flüssig (liquid) s . . . fest (solid)
Atzen von Platinen, Reinigung von Silber
In der Elektrotechnik wird bei der Herstellung von Platinen Kupfer von einer Trägerplatte an den Stellen abgelöst, an denen keine Leiterbahnen benötigt werden. Dazu taucht man die Platten in eine Eisen(III)-chlorid-Lösung. Aufgrund des höheren Redoxpotentials von U(Fe3+/Fe2+) = 0,77 V sind die Eisen(III)-Ionen in der Lage, Kupfer zu Kupfer(II)-Ionen zu oxidieren.
Silberne Gebrauchsgegenstände laufen an, da Silber mit Schwefelwasserstoff reagiert. Zur Reinigung des angelaufenen Silbers werden Putzmittel angeboten. Beim Putzen wird eine dünne Silberschicht abgerieben. Es geht also immer ein wenig Silber verloren.
Angelaufene Silbergegenstände kann man ohne Silberverlust reinigen, indem man das Silber in einer Natriumchlorid-Lösung auf Aluminiumfolie legt. Dabei reduziert Aluminium die Silber-Ionen aus der Anlaufschicht wieder zu Silber und Aluminium-Ionen gehen in Lösung.
1.3 Batterien
Batterien sind ortsunabhängige Spannungsquellen, bei denen die zum Betrieb von Geräten benötigte elektrische Energie elektrochemisch erzeugt wird. Batterien sind somit spezielle galvanische Zellen. Die verschiedenen Batterietypen unterscheiden sich durch die in ihnen ablaufenden Redoxreaktionen und durch ihren Bau.
Die an den Elektroden ablaufenden Reaktionen entscheiden über die Spannung der Batterie. Um hohe Spannungen zu erreichen, muss man ein unedles Metall am Minuspol mit einem starken Oxidationsmittel am Pluspol kombinieren.
Aus praktischen und ökonomischen Gründen ist die Auswahl sehr beschränkt. So eignet sich als negative Elektrode besonders gut das Metall Zink. Auch Lithium und Natrium werden verwendet. Neben der Spannung sind auch die erreichbare Stromstärke und die Kapazität einer Batterie von Bedeutung. Sie werden durch die Größe der Elektroden und die Art der Elektrolytlösung beeinflusst.
Die LECLANCHE-Batterie
Die am häufigsten verwendete Batterie ist die so genannte Taschenlampenbatterie. Sie geht auf eine Entwicklung des französischen Ingenieurs Georges LECLANCHE zurück, der seine Erfindung 1867 auf der Weltausstellung in Paris vorstellte.
Bei der heutigen Ausführung der LECLANCHE-Batterie ist der Batteriebehälter aus Zink gleichzeitig der Minuspol. Den Pluspol bildet ein Graphitstab, der von einem Gemisch aus Graphit und Braunstein umgeben ist.
Als Elektrolyt dient eine 20%ige Ammoniumchlorid-Lösung, die mit Quellmitteln wie Stärke oder Sägemehl eingedickt ist.
Beim Betrieb der LECLANCHE-Batterie wird am Minuspol das Zink oxidiert, Zink-Ionen gehen in den Elektrolyten über:
Zn → Zn2+ + 2e-
Die Reaktionen am Pluspol sind kompliziert. Letztlich wird Braunstein reduziert. Dabei werden Hydronium-Ionen aus der schwach sauren Ammoniumchlorid-Lösung verbraucht:
Die Arbeitsspannung sinkt bei fallender Temperatur stark ab, da die Beweglichkeit d. Ionen u. die Löslichkeit im Elektrolyten abnehmen. Unterhalb von - 20 °C gefriert der Elektrolyt; Ionenwanderung ist dann kaum möglich.
LECLANCHE-Batterien lassen sich nicht beliebig lange ohne Qualitätsminderung lagern. Schon durch geringen Wasserverlust wird die Elektrolytpaste zäh, und Salze kristallisieren aus. Verunreinigungen des Zinks durch Spuren von Eisen und Kupfer führen zur Ausbildung von Lokalelementen und wirken korrodierend, sodass schon während der Lagerung Zink-Ionen in Lösung gehen.
Die Alkali-Mangan-Batterie
|
+IV -II 2 Mn02 + 2 H 2e- |
Eine Weiterentwicklung der LECLANCHE-Batterie ist die Alkali-Mangan-Batterie. Der Batteriebecher besteht aus Stahl, der an den elektrochemischen Reaktionen nicht teilnimmt. Somit ist die Batterie nahezu auslaufsicher. Am Minuspol liegt eine Paste aus amalgiertem Zinkpulver vor. Durch die größere Zinkoberfläche kann pro Zeiteinheit mehr Zink oxidiert werden und durch das freigesetzte Quecksilber wird der Innenwiderstand der Batterie verringert.
|
2 MnO(OH) |
|
+III -II -II +I |
So können über längere Zeit höhere Entladeströme fließen, ohne dass die Spannung zu weit absinkt. Als Elektrolyt wird Kaliumhydroxid-Lösung verwendet. Da die Kaliumhydroxid-Lösung erst bei - 60 °C vollständig erstarrt ist die Alkali-Mangan-Batterie auch bei tiefen Temperaturen einsetzbar.
Die Zink-Luft-Batterie
Anstelle Braunsteins lässt sich auch der Luftsauerstoff als Oxidationsmittel nutzen. In der Zink-Luft-Batterie bildet Zink den Minuspol und ein Graphitstab den Pluspol. Die Graphit-Elektrode taucht nur teilweise in die als Elektrolyt verwendete Kaliumhydroxid-Lösung. Der andere Teil steht mit Luftsauerstoff in Verbindung, der von der Elektrode absorbiert wird.
Unter der katalytischen Wirkung des Elektrodenmaterials wird der Sauerstoff zu Hydroxid-Ionen reduziert, gleichzeitig wird das Zink oxidiert. Die Zink-Ionen reagieren mit den Hydroxid-Ionen weiter zu Hydroxozinkat-Ionen ([Zn(OH)4]2-).
Die Zink-Luft-Batterie wird als Großbatterie für Langzeitanwendungen eingesetzt, so für Weidezaungeräte und Baustellenbeleuchtungen. Als Knopfzelle findet sie in Hörgeräten Verwendung.
![]()
![]()
Die Quecksilberoxid-Batterie und die Silberoxid-Batterie
Vorteilhaft für die elektrischen Eigenschaften ist die Verwendung von Quecksilberoxid oder Silberoxid als Oxidationsmittel am Pluspol. Als Reduktionsmittel verwendet man in Quecksilberoxid- und Silberoxid-Batterien ebenfalls Zink. Als Elektrolyt dient Kaliumhydroxid-Lösung. In der Quecksilberoxid-Batterie laufen folgende Reaktionen ab:
Quecksilberoxid- und Silberoxid-Batterien haben einen großen Vorteil: die Spannung von 1,3 V bzw. 1,5 V bleibt während ihrer gesamten Betriebszeit konstant. Sie werden meist als Knopfzellen gefertigt. Verwendung: Fotoapparate, Armbanduhren und Messgeräte.
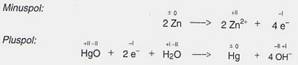
Die Lithium-Batterie
Aufgrund seiner Stellung in der Spannungsreihe und seiner geringen Dichte ist Lithium bestens als Elektrodenmaterial für den Minuspol in Batterien geeignet. Lithium reagiert aber lebhaft mit Wasser, sodass man in der Batterie nur nichtwässrige Elektrolyte einsetzen kann. Für den Pluspol werden unterschiedliche Oxidationsmittel verwendet. Eine Elektrode aus Edelstahl steht in Kontakt mit Chromoxid (CrOx), Braunstein, Thionylchlorid (SOCl2) oder Bismutoxid (Bi2O3). Dabei ergeben sich je nach Oxidationsmittel unterschiedliche Batteriespannungen.
Als Beispiel soll das System Li/CrOx dargestellt werden. Man verwendet ein Gemisch von Chromoxiden, deren Gesamtzusammensetzung etwa der Formel Cr3O8 entspricht. Bei der Zellreaktion wird Lithium zu Lithium-Ionen oxidiert, und Chromoxide werden reduziert. Im rechnerischen Durchschnitt nimmt ein Chrom-Ion dabei 1,4 Elektronen auf.
Als Elektrolyt wird in dieser Lithium-Batterie eine Lösung von Lithium-perchlorat (LiClO4) in einem polaren organischen Lösungsmittel eingesetzt.
Lithium-Batterien zeichnen sich durch sehr geringe Selbstentladung und somit hohe Lagerfähigkeit aus. Bei geringen Entladeströmen eignen sie sich für Langzeitanwendungen von bis zu 10 Jahren. So werden sie in EDV-Anlagen in die Platinen von Datenspeichern eingelötet. Lithium-Batterien sind bei Temperaturen bis zu - 40 °C einsetzbar.
Batterien im Müll - ein Umweltproblem?
In Österreich werden pro Jahr etwa 50 Millionen Batterien verkauft. Nach ihrem Gebrauch fällt damit insgesamt eine Menge von rund 2000 Tonnen Altbatterien an. Die Entsorgung über den Hausmüll ist sehr problematisch, da in diesen Batterien mehr als 7 Tonnen giftiges Quecksilber enthalten sind.
Der größte Teil davon entfällt auf die Alkali-Mangan-Batterien. Sie enthalten zwar nur etwa 1 % Quecksilber, haben aber an der Gesamtmasse einen viel größeren Anteil als die Quecksilberoxid-Batterien.
Der Anteil des Quecksilbers im Hausmüll beträgt etwa 3 ppm (parts per million). Die Hälfte davon ist auf Batterien zurückzuführen. In der Hausmülldeponie korrodieren die Batterien nach einiger Zeit. Das freigesetzte Quecksilber verdampft teilweise in die Atomsphäre, zum anderen Teil wird es in der Deponie gebunden. In Müllverbrennungsanlagen verdampft das Quecksilber vollständig. Die Hälfte der Emissionen an Quecksilber aus Müllverbrennungsanlagen stammt aus Batterien. So gelangt jährlich eine knappe Tonne in die Atmosphäre.
Aus der Luft gelangt schließlich immer mehr Quecksilber in den Boden und in das Wasser. Eine akute Gefährdung durch das Quecksilber besteht zwar nicht, aber ökologische Schäden sind langfristig zu befürchten, da Organismen im Boden und im Wasser giftige organische Quecksilberverbindungen aufbauen, die sich in der Umwelt und vor allem in der Nahrungskette anreichern können.
Neben Quecksilber enthalten Batterieabfälle auch das giftige Cadmium. Es stammt hauptsächlich aus den immer beliebter werdenden, wiederaufladbaren Nickel-Cadmium-Batterien. Ein Viertel der Cadmiumbelastung im Müll ist auf diese Batterien zurückzuführen.
Quecksilberhältige Batterien und cadmiumhältige Batterien gehören also nicht in den Hausmüll, sondern sollten gesondert gesammelt werden. Nur so können sie in einer Sondermülldeponie eingelagert oder einem Recycling zugeführt werden.
Recycling
Knopfzellen werden vom Handel zurückgenommen. Wegen ihrer Form lassen sie sich auch leicht aus dem Batteriemüll aussortieren. Aufgrund des hohen Gehalts an Quecksilber und wertvollem Silber werden Recycling-Verfahren seit Jahren wirtschaftlich lohnend durchgeführt. Die Stahlmantel werden zerschlagen, und zunächst wird das Quecksilber abdestilliert. Danach wird das fein verteilte Silber zusammengeschmolzen.
Die quecksilberhältigen Alkali-Mangan-Batterien lassen sich nur schwer aus den gesammelten Batterien abtrennen, da sie die gleiche Form aufweisen wie die LECLANCHE-Batterien. Unsortiert ist aber die Entsorgung problematisch. Bei der Lagerung auf einer Sondermülldeponie werden 65 % der Altbatterien praktisch unnötigerweise gelagert, da die LECLANCHE-Batterien kein Quecksilber enthalten. Recycling ist aber wegen des geringen Quecksilbergehalts an der Gesamtmasse unwirtschaftlich. Einen Fortschritt könnte hier ein Recycling-Verfahren bringen, bei dem auch Zink und Braunstein zurückgewonnen werden.
Beim umweltbewussten Einsatz von Batterien muss man also überlegen, ob man statt Alkali-Mangan-Batterien LECLANCHE-Batterien und statt Quecksilberoxid-Knopfzellen Zink-Luft-Knopfzellen oder Lithium-Knopfzellen verwendet. Darüber hinaus ist vorgesehen, den Quecksilbergehalt der Alkali-Mangan-Batterien von 1 % auf 0,15 % herabzusetzen.
1.4 Akkumulatoren
Die bisher vorgestellten Batterien haben den Nachteil, dass sie nach Gebrauch nicht wieder regeneriert werden können. Große praktische Bedeutung kommt daher den Akkumulatoren zu. Bei diesen Batterien lassen sich die bei der Stromerzeugung ablaufenden Reaktionen wieder rückgängig machen.
Der Bleiakkumulator
In geladenem Zustand besteht jede Zelle des Bleiakkumulators aus einer Blei-Elektrode und einer Bleidioxid-Elektrode, die in Schwefelsäure (20 %) als Elektrolyt eintauchen. Jede einzelne Zelle besitzt eine Spannung von etwa 2 V. Bei Stromentnahme laufen an den Elektroden folgende Reaktionen ab:
Minuspol: Pb --> Pb 2+ + 2 e-
Pluspol: PbO2 + 4 H+ + 2 e - --> Pb 2+ + 2 H2O
Die an beiden Polen entstehenden Blei(Il)-Ionen bilden mit den Sulfat-Ionen des Elektrolyten einen schwerlöslichen Niederschlag von Bleisulfat, der sich auf den Elektroden absetzt. Außerdem entsteht bei der Stromerzeugung Wasser. Die Reaktion lässt sich umkehren, der entladene Bleiakku kann also wieder aufgeladen werden.
Pb + PbO2 + 2 H2SO4 ![]() 2 PbSO4 + 2 H2O
2 PbSO4 + 2 H2O
Die Umkehrreaktion wird erzwungen, indem man durch Anlegen einer Spannung an die Elektroden die Stromrichtung umkehrt. Dabei werden am Minuspol Blei(Il)-Ionen wieder zu Blei reduziert und am Pluspol Blei(Il)-Ionen wieder zu Blei(IV)-oxid oxidiert.
Beim Ladevorgang könnte man erwarten, dass der Bleiakku als Elektrolytzelle arbeitet und die schwefelsaure Lösung unter Bildung von Wasserstoff und Sauerstoff elektrolysiert wird. Die Entwicklung von Wasserstoff an einer Bleielektrode und die Abscheidung von Sauerstoff einer Bleidioxid-Elektrode sind jedoch stark behindert, sodass bevorzugt die Blei(Il)-Ionen an den Elektroden reagieren. So wird das Laden des Bleiakkumulators überhaupt erst möglich.
Solange noch festes Bleisulfat vorhanden ist, bleibt während des Ladevorgangs die Konzentration an Blei(Il)-Ionen im Elektrolyten auf Grund des Löslichkeitsgleichgewichts nahezu konstant. Gegen Ende der Aufladung aber nimmt dann die Konzentration an Blei(Il)-Ionen schlagartig ab, und es kommt schließlich zur Entwicklung von Wasserstoff und Sauerstoff. Dann läuft die Elektrolyse des Wassers ab, der Akku gast.
Der Nickel-Cadmium-Akkumulator
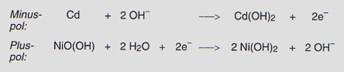 Im geladenen Zustand
bestehen die Elektroden dieses Akkumulators aus Platten, die am Minuspol mit
fein verteiltem Cadmium und am Pluspol mit Nickel(III)-oxidhydroxid beladen
sind. Als Elektrolyt wird Kaliumhydroxid-Lösung (20 %) verwendet. Der
Nickel-Cadmium-Akkumulator liefert eine Spannung v. 1,3 V. Beim Entladen laufen
folgende Reaktionen ab:
Im geladenen Zustand
bestehen die Elektroden dieses Akkumulators aus Platten, die am Minuspol mit
fein verteiltem Cadmium und am Pluspol mit Nickel(III)-oxidhydroxid beladen
sind. Als Elektrolyt wird Kaliumhydroxid-Lösung (20 %) verwendet. Der
Nickel-Cadmium-Akkumulator liefert eine Spannung v. 1,3 V. Beim Entladen laufen
folgende Reaktionen ab:
![]()
![]()
Durch Anlegen einer genügend großen Spannung lassen sich die Elektrodenreaktionen umkehren.
Entladen
Cd + 2 NiO(OH) + 2 H2O
![]() Cd(OH)2 + 2 Ni(OH)2
Cd(OH)2 + 2 Ni(OH)2
Laden
Der Nickel-Metallhybridakku
Vorteile des NiMH-Akkus:
Cadmiumfrei (umweltschonend!)
Höhere Energie von 50-70 Wh/Kg
Weist ähnliche Spannung wie NC-Zellen auf
Hohe Lebensdauer (bis 2000 Zyklen)
Ladewirkungsgrad bis zu 92%, dazu noch eine rel. kurze Ladezeit
Geringe Wartung benötigt
Nachteile des Ni/MH-Akkus:
Hoher Preis
Hochstromentladung max. 3C
Schnelle Selbstentladung
Starke Ausdehnung der Kristallgitter beim Ladevorgang daraus folgt eine
Verringerung der Lebensdauer
Irreversible Oxidation der H2-Speicherlegierungen Memory Effekt
Die Nickel-Metallhydrid-Batterie entstand bei der Suche nach einer
Zelle mit vergrößerter Kapazität und verbesserter Umweltverträglichkeit. Die
Negative, strukturell recht einfache Cadmium-Elektrode wurde hier durch eine
Metalllegierung mit komplexer Struktur ersetzt, die fähig ist, Wasserstoff zu
absorbieren.
Das Legierung-Wasserstoff-System weist eine hohe Energiedichte auf, was
erlaubt, die Masse der negativen Elektrode zu verringern und das gewonnene
Volumen mit positiver Masse aufzufüllen.
Dadurch erhöht sich die Energiedichte im Vergleich zu NiCd-Zelle.
Aufbau und Funktionsweise einer Ni-MH Zelle
Die Anode (-) besteht hier nicht aus Cadmium, sondern aus einer
wasserstoffspeichernden Nickellegierung. Die Kathode besteht wie schon beim
Ni/Cd-Akku aus Nickel.
Auch das Elektrolyt ist dasselbe, und zwar Kaliumhydroxid-lösung.
Beim Entladen laufen allgemein folgende Reaktionen ab:
MH + NiOOH -> M + Ni(OH)2
Es entsteht eine Leerlaufspannung von 1,25 bis 1,35 V. Sie ist vom
Ladezustand, der Lagerungszeit und der Temperatur abhängig. Unmittelbar nach
der Ladung kann auch mal 1,45V gemessen werden.
Die Nennspannung beträgt dennoch 1,2 V (ein Mittelwert der Spannungen im
Arbeitszyklus).
Die Entladeschlussspannung beträgt 1V, bei höheren Entladeströmen kann sie auch
auf 0,9V fallen.
Der Maximale Entladestrom beträgt nur 3C.
Die NiMH-Zellen sind nur eingeschränkt für unsere Zwecke brauchbar, da
der maximale Entladestrom mit 3C vergleichsweise gering ist.
Brauchbar sind die Zellen jedoch für den "Next Generation", der im Schwebeflug
weit weniger als 1A verbraucht. Bei den Indoor- und Parkflyeren wird der
Spitzenstrom zu hoch sein und die Zellen beschädigen.
Lithium-Ionen-Zellen:
beide Elektroden aus Einlagerungsverbindungen und flüssigem oder festem Polymer-Elektrolyten.
Merkmale:
Sicherer Aufbau
Hohe Lebensdauer
Relativ große Selbstentladung
Mittlere Entladungsströme
Beispiele: LixC/LiCOO2, LixC/LiNiO2,
LixC/LiMnO4
Zellen mit anorganischem Elektrolyten:
flüssige
Kathode, die gleichzeitig als Lösungsmittel des Elektrolyten dient.
Merkmale:
Hohe spezifische Energiedichte
Hohe Entladungsströme
Sehr gute Lagerungsfähigkeit
Widerstandsfähigkeit gegen Überladung
Sicherheitsprobleme (sehr giftig)
Kapazitätsverlust im Laufe des Lebens
Beispiele: Li/SO2, Li/CuCl2
Lithium-Legierungs-Zellen:
Anode aus Lithium-Legierung, flüssiger organischer Elektrolyt, verschiedene Kathoden.
Merkmale
Knopfzellenkonstruktion
Mehr Sicherheit durch Lithium-Legierung
Niedrige Energiedichte
Kurze Lebensdauer (außer für geringere Entladungstiefe)
Beispiele: LiAl/MnO2, LiAl/V2O5, LiAl/C, LiC/V2O5,
LiAl/Polymer
Die einzige Zelle aus der Lithium-Familie die für uns in Frage kommen
könnte, ist die Lithium-Ionen Zelle.
Sie besitzt eine extrem hohe Kapazität und eine hohe Zellspannung von 3,7V.
Widrigerweise beträgt die maximale Belastbarkeit nur 2C. Da die Kapazität der
Zellen entsprechender Größe jedoch über 1000mAh beträgt, reichen hier 2C für
den "Next Generation" aus.
Leider ist der Anschaffungspreis hoch.
Die Autobatterie
Der größte Teil der knapp 1 Million in Österreich jährlich verkauften Bleiakkumulatoren findet als Starterbatterie in Kraftfahrzeugen Verwendung.
Aufbau und Herstellung. Damit die Batterie beim Startvorgang kurzzeitig einen sehr hohen Strom liefern kann, müssen die Elektrodenflächen möglichst groß sein. Daher baut man in die Batterie viele dünne Elektrodenplatten ein. Die Platten bestehen aus einem Trägergitter und dem elektrochemisch aktiven Material. Da reines Blei weich und leicht verformbar ist, verwendete man für die Gitter lange Zeit Hartblei, eine Legierung aus Blei und 4% bis 10% Antimon. Der Antimonzusatz verbessert zwar die Festigkeit der Gitter und die Eigenschaften der Schmelze beim Gießen, er bringt aber Nachteile für das elektrochemische Verhalten des Akkus beim Betrieb. Man verwendet daher heute für die Gitter antimonarme Bleilegierungen (bis 1,7% Antimon) mit Zusätzen von Arsen (0,1 %), Kupfer (0,03 %), Zinn (0,01 %) und Selen (0,02 %).
Zur Herstellung des aktiven Materials geht man ausschließlich von reinem Blei (Weichblei) aus. Geschmolzenes Blei wird in feinen Tröpfchen an der Luft so weit oxidiert, bis ein Gemisch von etwa gleichen Anteilen Blei und Bleioxid entstanden ist. Dann wird das Material zu Pasten angerührt. Um an den negativen Platten eine feinste Verteilung des Bleis mit einer großen Oberfläche zu erhalten, werden der Paste Bariumsulfat, Ruß und Lignin als Spreizmittel zugesetzt. Die Paste für die positiven Platten erhält normalerweise keine Zusätze. Die Pasten werden in die Gitter gestrichen und anschließend getrocknet. Dann werden die Platten für den Minuspol und den Pluspol elektrochemisch hergestellt: Bleioxid wird zu Blei reduziert bzw. Bleioxid und Blei werden zu Bleidioxid oxidiert.
Die Platten einer Akkuzelle werden zu negativen und positiven Plattensätzen verschweißt. Für die Strom führenden Teile und die Pole verwendet man sogenanntes Schweißblei, das ist Hartblei mit 3% bis 6% Antimon. Um 12 V Spannung zu erreichen, schaltet man sechs Akkuzellen hintereinander. Die Schwefelsäure wird erst kurz vor Gebrauch eingefüllt, denn mit diesem Zeitpunkt setzt auch die Alterung der Batterie ein.
Alterung. Obwohl der Bleiakkumulator nach dem Start von der Lichtmaschine wieder geladen wird, besitzt er nur eine begrenzte Lebensdauer. Dafür sind Veränderungen an den Platten verantwortlich.
An den negativen Platten kann das feinkörnige Blei (Schwammblei) rekristallisieren, es wird kompakter und verliert seine große aktive Oberfläche. Mit der Zeit kann auch das beim Entladen entstandene Bleisulfat auf den Platten größere Kristalle bilden, die beim Laden nicht mehr vollständig gelöst werden.
An den positiven Platten kann beim Laden und Entladen ein Teil des porös aufgetragenen Bleidioxids die Haftung ans Gitter verlieren und abschlammen. Wird der Akku längere Zeit nicht voll geladen oder wird er tiefentladen, kommt es zu Korrosionsvorgängen an den Gittern der positiven Platten. Teile des Gitters, und damit auch Bleidioxid platzen ab. All diese Vorgänge führen dazu, dass die Leistung und die Kapazität des Bleiakkumulators während des Betriebs zunehmend geringer werden.
Moderne Batterien sind wartungsfrei. Durch die Verwendung antimonarmer Bleilegierungen für die Gitter wird das Gasen beim Laden verhindert. Somit braucht kein elektrolytisch zersetztes Wasser mehr nachgefüllt zu werden.
Soll ein Motor bei tiefen Temperaturen gestartet werden, kann es vorkommen, dass die Leistung der Batterie nicht mehr ausreicht. Der Motor benötigt hauptsächlich wegen des bei tiefen Temperaturen zähflüssigen Motoröls eine höhere Startleistung. Aber durch die geringere Ionenbeweglichkeit und die Verlangsamung der Reaktionen nimmt der Innenwiderstand der Batterie zu. So sinkt bei fallenden Temperaturen die Arbeitsspannung der Batterie und die entnehmbare Strommenge. Eine Faustregel besagt, dass man ausgehend von 27 °C pro Grad Temperaturerniedrigung mit einer Kapazitätsminderung von etwa 1,3% rechnen muss.
Über 90% der ausgedienten Bleiakkus werden wiederaufgearbeitet. Aus den Platten gewinnt man Hartblei zurück. Die Kunststoffbehälter verarbeitet man zu Granulat, aus dem sich neue Gegenstände fertigen lassen.
1.5 Brennstoffzellen
In galvanischen Zellen wird die bei einer Redoxreaktion freiwerdende Energie direkt in elektrische Energie umgewandelt. Auch Verbrennungsreaktionen sind Redoxreaktionen. Sie lassen sich daher in galvanischen Zellen zur Stromerzeugung einsetzen. Man muss nur dafür sorgen, dass die Brennstoffe kontinuierlich nachgeführt werden, sodass über längere Zeit Energie bereitgestellt wird. Solche Zellen heißen Brennstoffzellen.
Knallgaszellen
In einer Wasserstoff-Sauerstoff-Brennstoffzelle wird die stark exotherm verlaufende Oxidation von Wasserstoff zur Stromerzeugung genutzt. Allerdings reagieren Wasserstoff und Sauerstoff nicht direkt miteinander. Durch die räumliche Trennung der beiden Reaktionspartner wird der größte Teil der chemischen Energie in elektrische Energie umgewandelt. In einer Zelle mit Kalilauge als Elektrolyten laufen an den Elektroden die folgenden Reaktionen ab:
Minuspol: 2 H2 + 4 OH- → 4 H2O + 4e- U= - 0,87 V
Pluspol: O2 + 2 H2O + 4e- → 4 OH- U= 0,36 V
Gesamtreaktion: 2 H2 + O2 → 2 H2O U= 1,23 V
Möglichkeiten und Probleme
Brennstoffzellen sind in den letzten Jahren viel in der Raumfahrt eingesetzt worden. Die Apollo- Raumfahrzeuge wurden mit Strom aus Wasserstoff-Sauerstoff-Brennstoffzellen versorgt. Die beiden Gase wurden in flüssiger Form in Tanks mitgeführt. Das Endprodukt der Reaktion diente als Trinkwasser. Das Gesamtgewicht des Stromversorgungssystems betrug etwa 800 kg. Hätte man Batterien verwendet, so wäre das Gewicht des Aggregats etwa zehnmal so hoch gewesen.
Brennstoffzellen können vielseitig eingesetzt werden. Man erprobt sie zur Zeit in Autos, Booten und Gabelstaplern. Sie werden im militärischen Bereich als mobile Stromquellen verwendet und stehen auch als Notstromaggregate zur Verfügung. Als einzige Großanlage existiert bisher eine Anlage in New York mit einer Leistung von 4,8 Megawatt. Der notwendige Wasserstoff wird durch Umsetzung von Erdgas oder Kohle mit Wasserdampf hergestellt.
Im Gegensatz zu Akkumulatoren benötigen Brennstoffzellen keine Ladezeiten, sie können kontinuierlich betrieben werden. Ihr Wirkungsgrad ist etwa doppelt so hoch wie der eines Benzinmotors. Sie laufen geräuschlos und sind umweltfreundlich. Die Ausgangsstoffe für eine Wasserstoff-Sauerstoff-Zelle lassen sich leicht herstellen und stehen fast unbegrenzt zur Verfügung. Allerdings liegen die Kosten für die Stromerzeugung noch weit höher als bei den herkömmlichen Konkurrenten. Das liegt vor allem an dem noch sehr hohen Preis für Wasserstoff.
Andere Brennstoffe
Grundsätzlich sind mehrere Alternativen zu Wasserstoff als Brennstoff denkbar. Hydrazin (N2H4) ist gut geeignet. Es ist bei Zimmertemperatur flüssig und bildet in Reaktion mit Sauerstoff Produkte, welche die Umwelt nicht schädigen (Stickstoff, Wasser).
Hydrazin zählt allerdings zu den Krebs erzeugenden Arbeitsstoffen, außerdem ist es sehr teuer. Es wird nur in der Raumfahrt eingesetzt. In weiteren Versuchen wird auch Methanol als Brennstoff erprobt.
In letzter Zeit geht die Forschung allerdings noch in eine andere Richtung: Man versucht Brennstoffzellen mit einem festen Elektrolyten zu entwickeln. Diese keramischen Zellen werden bei einer Temperatur um 1000 °C betrieben. In ihnen könnten auch natürlich vorkommende Energieträger wie Erdgas oder Erdöl umgesetzt werden. Ihr Wirkungsgrad soll deutlich höher liegen als bei herkömmlichen Zellen.
2. Die Elektrolyse - eine erzwungene Redox-Reaktion
Prüft man Stoffe auf ihre Leitfähigkeit, so stellt man fest, dass neben Metallen auch Salzschmelzen und Salzlösungen elektrischen Strom leiten. Diese Stoffe enthalten bewegliche Ionen, man nennt sie Elektrolyte. Bei Durchfluss von Gleichstrom zersetzen sich die Elektrolyte.
Die Zerlegung eines Elektrolyten durch den elektrischen Strom nennt man Elektrolyse.
Elektrolysen sind endotherme Reaktionen. Die notwendige Energie wird in Form von elektrischer Energie zugeführt und in chemische Energie umgewandelt.
Damit die chemische Reaktion bei der Elektrolyse einsetzt, benötigt man eine Mindestspannung der Gleichstromquelle, die Zersetzungsspannung. Oft beeinflussen Elektrodenmaterial, Temperatur und die Art der abgeschiedenen Stoffe die Elektrolyse, und man muss eine höhere Spannung als berechnet - die Oberspannung - zum Start der Elektrolyse anlegen.
Welche Vorgänge spielen sich bei der Elektrolyse ab?
Beispiel: Elektrolyse einer wässrigen Kupfer(II)-chlorid-Lösung
Taucht man zwei Kohleelektroden in eine CuCl2-Lösung und verbindet sie mit einer Gleichstromquelle, so fließt ein Strom. An der positiven Elektrode, der Anode, beobachtet man die Entwicklung eines gelbgrünen Gases; es handelt sich um Chlor. An der negativen Elektrode, der Katode, entsteht Kupfer. Kupferchlorid ist durch den elektrischen Strom in die Elemente Chlor und Kupfer zerlegt werden.
Vorgänge an der Anode
Die negativen Chlorid-Ionen wandern zur Anode. Sie besitzen im Gegensatz zum Chloratom ein überzähliges Elektron. Dieses wird von der Anode aufgenommen.
Zwei Chloratome verbinden sich sofort zu einem Chlormolekül. Man sieht, dass dem Chlorid-Ion bei der Reaktion ein Elektron entzogen wird - es wird oxidiert.
2 Cl- ---> Cl2 + 2 e- Oxidation
Vorgänge an der Katode
Die positiven Kupfer-Ionen wandern zur Katode. Dort werden sie durch die Aufnahme von Elektronen entladen - sie werden reduziert.
Cu2+ + 2 e- --> Cu Reduktion
Gesamtreaktion
2 Cl- + Cu2+ --> Cl2 + Cu Redox-Reaktion
In einer Elektrolytlösung befinden sich meist mehrere verschiedene oxidierbare bzw. reduzierbare Stoffe. An den Elektroden reagieren die Stoffe zuerst, die am leichtesten oxidiert bzw. reduziert werden. Auch das Elektrodenmaterial kann reagieren, wenn kein Stoff in der Lösung vorhanden ist, der leichter reagieren kann.
Beispiel: Elektrolyse von verdünnter Schwefelsäure
Folgende Teilchen sind in der Lösung vorhanden:H3O+ Hydronium-Ionen, H2O Wassermoleküle, SO42- Sulfat-Ionen.
An der Anode werden Wassermoleküle zu Sauerstoff oxidiert, da sich die Sulfat-Ionen schwerer oxidieren lassen als das Wassermolekül. An der Katode werden Hydronium-Ionen zu Wasserstoff reduziert. Die verwendeten Platinelektroden sind an der Reaktion nicht beteiligt, da sie nur sehr schwer reagieren.
Anode: 6 H2O --> 4 H3O+ + O2 + 4 e-
Katode: 4 H3O+ + 4 e- --> 4 H2O + 2 H2
Anwendung der Elektrolyse in Labor und Technik
Gewinnung unedler Metalle aus den Verbindungen (Alkalimetalle, Erdalkalimetalle)
Reinigung von Metallen (z.B. Raffination von Kupfer)
Herstellung einiger Elemente (z.B. Chlor, Brom)
Herstellung metallischer Überzüge (z.B. Galvanotechnik)
Quantitative Beziehungen
Die bei der Elektrolyse geflossene Ladung Q berechnet man aus der Elektrolysedauer t und der Stromstärke I:
Q = I ∙ t
FARADAY stellte 1833 den Zusammenhang zwischen der abgeschiedenen Stoffmenge n und der geflossenen Ladung Q fest.
Die bei einer Elektrolyse abgeschiedene Stoffmenge n ist der durch den Elektrolyten geflossenen Ladung Q proportional: n ≈ Q.
So wird durch die Ladungsmenge von 96 486 A stets ein Mol Silber-Ionen oder anderer einwertiger Ionen abgeschieden. Ein Mol zweiwertige Ionen benötigt eine doppelt so große Ladungsmenge. Insgesamt gilt der Zusammenhang: I ∙ t = n F z. Als neue Größen treten hier die FARADAY-Konstante F= 96 486 A ∙ s ∙ mol-1 und die Ionenladungszahl z auf.
2.1 Galvanotechnik
Chromglänzende Radkappen und Zierleisten am Auto, vernickelte Hausschlüssel, versilbertes Besteck, verzinkte Schrauben für den Heimwerker; verchromte Armaturen im Badezimmer und vergoldete Schmuckstucke - man begegnet Produkten der Galvanotechnik überall im täglichen Leben. Aber nicht allein aus Freude an glänzenden Oberflächen werden Gegenstände galvanisiert. Meist geht es darum, Metalle durch eine Schicht aus einem widerstandsfähigeren Metall vor Korrosion zu schützen.
Eine wesentliche Voraussetzung für gut haltende galvanische Überzüge ist die sorgfältige Vorbehandlung der Grundmetalle. Die Oberfläche wird mit Hilfe von Säuren von Oxidschichten befreit. Sie muss mechanisch glatt poliert und mit organischen Lösungsmitteln entfettet werden.
Beim Galvanisieren werden die Werkstücke in eine Salzlösung des Überzugmetalls getaucht und als Katode geschaltet. Als Anode dient ein Stück des Überzugmetalls, das sich bei dem Vorgang langsam auflöst. Auf diese Weise bleibt die Konzentration der Ionen im Elektrolyten konstant. Denn es gehen genauso viele Ionen in Lösung, wie an der Katode abgeschieden werden.
Um gleichmäßige Metallüberzüge zu erhalten, muss pro Zeiteinheit eine kleine, gleich bleibende Menge an Metall abgeschieden werden. In galvanischen Bädern verwendet man deshalb häufig Lösungen von Cyano-Komplexen des abzuscheidenden Metalls. Zwischen den komplex gebundenen und den freien hydratisierten Metall-Ionen stellt sich ein Gleichgewicht ein.
[Ag(CN)2]- ![]() Ag+ + 2 CN-
Ag+ + 2 CN-
Die Konzentration der hydratisierten Kationen ist dabei sehr klein. Sie wird während des Galvanisierens konstant gehalten, da die verbrauchten Metall-Ionen kontinuierlich durch den Zerfall des Cyano-Komplexes nachgebildet werden.
Eine interessante Anwendung des Galvanisierens ist die Galvanoplastik. Mit Hilfe dieses Verfahrens lassen sich maßgetreue Nachbildungen dreidimensionaler Gegenstände herstellen. Von dem Original wird zunächst aus Silicon ein Negativ-Abdruck angefertigt, eine so genannte Matrize. Dann wird Graphitpulver auf die Matrize gepinselt; die Oberfläche des Siliconabdrucks wird dadurch elektrisch leitend. In einem geeigneten Bad wird der Abdruck durch Galvanisieren mit einem Metallüberzug versehen. Nach dem Entfernen der Siliconschicht liegt eine Kopie des Originals vor, die noch weiter bearbeitet werden kann.
3. Korrosion - Redoxreaktion auf Abwegen
Jeder kennt das Problem aus dem Alltag: Metalle verändern sich mit der Zeit, wenn sie Luft und Wasser ausgesetzt sind, sie korrodieren. Fahrräder rosten, Wasserleitungsrohre werden undicht, in Druckkesseln bilden sich Risse.
3.1 Arten der Korrosion
Die meisten dieser Vorgänge lassen sich auf zwei grundlegende Arten der Korrosion zurückführen: Bei der Säure-Korrosion werden Metalle durch Hydronium-Ionen oxidiert, es bildet sich Wasserstoff. Bei der Sauerstoff-Korrosion wirkt Sauerstoff als Oxidationsmittel, er wird zu Hydroxid-Ionen reduziert.
Säure-Korrosion
Viele Metalle sind durch andere Metalle verunreinigt. So ist beispielsweise in technischem Zink immer etwas Kupfer zu finden. Wenn dieses Zink mit CO2-hältigem Wasser in Berührung kommt, bildet sich zwischen Zink und Kupfer eine kurzgeschlossene galvanische Zelle, ein Lokalelement.
Der Vergleich der Standard -Elektrodenpotentiale der beiden Metalle ergibt eine Differenz von 1,11 Volt. Das unedlere Zink geht daher an den Berührungsstellen zwischen Zink und Kupfer unter Abgabe von Elektronen in Lösung. Diese fließen zum edleren Kupfer und reduzieren an der Grenzfläche zwischen Kupfer und Wasser Hydronium-Ionen, die sich durch die Protolyse der Kohlensäure gebildet haben.
Zn + 2 H+ ---> Zn2+ H2
Die Oberfläche des Zinks wird ständig abgetragen, sodass sich unter Einwirkung des Elektrolyten auch weiter im Inneren Lokalelemente bilden und sich das unedlere Zink im Lauf der Zeit auflöst.
Sauerstoff-Korrosion
Ahnlich wie Zink korrodiert auch Eisen schnell, wenn es mit säurehältigem Wasser in Berührung kommt. Entscheidend für die Zerstörung des Metalls in neutralen oder alkalischen Lösungen ist jedoch der im Wasser gelöste Luftsauerstoff. Eisen gibt Elektronen an den Sauerstoff ab, es entstehen Eisen(II)-Ionen, die im Wasser gelöst werden. Edlere Fremdmetalle im Eisen oder auch Eisenoxid fördern dabei die Elektronenabgabe.
Beim Rosten müssen also sowohl Sauerstoff als auch Wasser vorhanden sein. Die Hydroxid-Ionen bilden sich bevorzugt in sauerstoffreichen Zonen des Wassers, während die Eisen(II)-Ionen in sauerstoffarmen Bereichen entstehen. Durch Diffusion treffen die Eisen(II)-Ionen und die Hydroxid-Ionen aufeinander. Es bildet sich ein Niederschlag aus Eisen(II)-hydroxid. Luftsauerstoff bewirkt dann die Bildung einer porösen Rostschicht, die vor allem aus wasserhältigem Eisen(III)-oxid besteht.
Es entstehen bei diesem Vorgang jedoch auch noch andere Eisenoxide, z.B. Eisen(II, III)-oxid Fe3O4.
Die Rostschicht kann das Eisen nicht vor weiterer Korrosion schützen, weil die Stelle, an der das Eisen in Lösung geht, nicht mit dem Ort der Rostentstehung identisch ist.
3.2 Korrosionsschutz
Durch Korrosion von Metallen wird die Wirtschaft von Industrieländern erheblich geschädigt. Neben der Zerstörung der Metalle kommt es häufig auch noch zu Folgeschäden: Produktionsanlagen fallen aus, wenn korrodierte Teile ersetzt werden müssen, undichte Wasser- oder Gasleitungen führen zu gefährlichen Unfällen. Öl läuft aus beschädigten Tanks aus und verschmutzt die Umwelt. Überlegungen zum Korrosionsschutz sind daher nicht nur aus finanziellen Gründen wichtig.
Überzüge
Man kann Metalle vor Korrosion schützen,
indem man sie mit einer Schicht aus einem korrosionsbeständigeren Metall
überzieht, die Luft und Feuchtigkeit fernhält. So werden Stahlbleche für die
Autoherstellung in eine
450 °C heiße Schmelze von flüssigem Zink getaucht (Feuerverzinken).
![]() An der Grenzfläche der
beiden Metalle bildet sich eine Zink-Eisen-Legierung. Die Stahloberfläche
erhält eine etwa 15 µm dicke Schicht aus Zink, die korrosionsbeständig ist, da
Zink an der Luft eine schützende Oxidschicht ausbildet. Energiebedarf und
Materialverbrauch sind allerdings relativ hoch.
An der Grenzfläche der
beiden Metalle bildet sich eine Zink-Eisen-Legierung. Die Stahloberfläche
erhält eine etwa 15 µm dicke Schicht aus Zink, die korrosionsbeständig ist, da
Zink an der Luft eine schützende Oxidschicht ausbildet. Energiebedarf und
Materialverbrauch sind allerdings relativ hoch.
Stahlbleche lassen sich auch durch Elektrolyse verzinken. Dazu wird das Blech in eine wässrige Zinksalz-Lösung gehängt und als Katode geschaltet. Als Anode dient eine Zinkplatte. Bei einer Gleichspannung von 20 V entsteht eine etwa 5 µm dünne Zinkschicht, die bei sorgfältiger Vorbehandlung der Stahloberfläche gut auf dem Metall haftet.
Autos können noch durch weitere Maßnahmen gegen Korrosion geschützt werden; etwa dadurch, dass die Rohkarosserie eine Phosphatierstraße durchläuft. Zunächst wird dabei die Metalloberfläche in einem Reinigungsbad von Schmutz, Öl und Fett befreit. Das Auto gelangt dann in ein Tauchbad, das Phosphorsäure oder eine Lösung von Hydrogenphosphaten enthält. Dabei bildet sich eine mit dem Metall fest verbundene Schicht aus Eisen- und Zinkphosphaten, auf die dann der Lack aufgetragen werden kann. In die Hohlräume von Automobilen wird flüssiges Wachs eingespritzt, der Unterbodenschutz besteht meist aus Polyvinylchlorid (PVC).
Nichtmetallüberzüge spielen seit alters her eine wichtige Rolle beim Korrosionsschutz. Römische Soldaten behandelten die Eisenrahmen von Katapulten und Pfeilgeschützen mit Pflanzenölen. Auch heute werden Maschinenteile und Waffen zur Pflege eingeölt. Durch Mischen von Minium (Pb3O4) mit Leinöl erhält man eine gut deckende Anstrichfarbe zum Schutz von Eisenkonstruktionen.
Bei einigen Metallen ergeben sich Überzüge an Luft auf natürlichem Weg. Aluminium, Chrom und Nickel bilden ähnlich wie Zink dünne Oxidationsschichten aus, die die Korrosion des darunter liegenden Metalls verhindern. Man spricht von Passivierung.
Katodischer Schutz
Um die Korrosion von Tanklagern, unterirdisch verlegten Rohren oder auch Erdölbohrtürmen im Meerwasser zu vermeiden, verbindet man das gefährdete Metall elektrisch leitend mit einem Metall, das sich leichter oxidieren lässt.
Aus dem gleichen Grund werden an den Eisenteilen von Hochseeschiffen Zinkplatten angebracht. Das unedlere Zink gibt über das Eisen Elektronen an Akzeptoren im Meerwasser (z.B. Sauerstoff) ab. Der Anodenvorgang der galvanischen Zelle - die Oxidation - findet also am Zink statt. Es löst sich langsam auf (Opferanode), das Eisen bleibt unbeschädigt.
Quellen: Von der Chemie
Der große Brockhaus auf CD-ROM
Bertelsmann 2001 auf DVD
Internet: http://home.t-online.de/home/e-huber/Antr/Akku.html
Haupt | Fügen Sie Referat | Kontakt | Impressum | Nutzungsbedingungen
