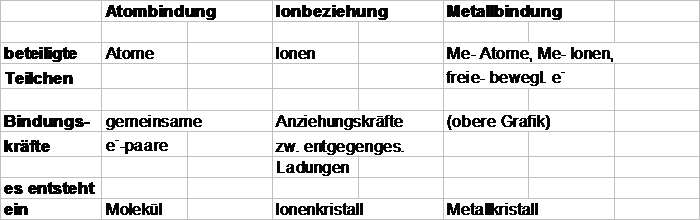
Bindungsarten
Grundlagen aller Stoffe = Teilchen
z.B. Sauerstoff- Atom
Elektronen in der Atomhülle Protonen im Atomkern Elektronenschalen
Außenelektonen (nur diese sind an der
chem. Reaktion beteiligt)
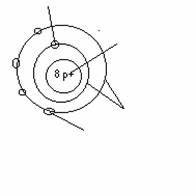
Anzahl p+ = Anzahl e-
Atome sind
elektrisch neutral
![]()
Jedes Atom ist bestrebt, einen stabilen Zustand zu erreichen, d.h.
entweder eine 1. Schale (gilt nur für die Elemente 1- 5)
oder 8 Außenelektronen
![]()
![]()
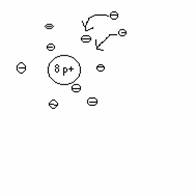
'Gegenseitiges Borgen' e- aufnahme oder e- abgabe
von Außenelektronen
z.B. Sauerstoff
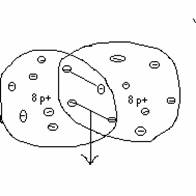
![]() gemeinsame Elektronenpaare, 8
p+ Entstehung eines 2- fach
negativ
gemeinsame Elektronenpaare, 8
p+ Entstehung eines 2- fach
negativ
umkreisen beide Atomkerne 10 e- geladenen Teilchen
![]() Entstehung
eines neuen
Entstehung
eines neuen
Teilchens = Ion
(Oxid- Ion)
=
Molekühl - entgegengesetzte Ladungen der Ionen führen zu
![]() starken Anziehungskräften zwischen den Ionen
starken Anziehungskräften zwischen den Ionen
![]() Ionen
ordnen sich regelmäßog in
Ionen
ordnen sich regelmäßog in
Atombindung einen Ionenkristall
![]()
Ionenbeziehung

 Atombindung
Atombindung
- etwa gleichgroße Atome üben - unterschiedlich Große Atome
fast gleichstarke Anziehungskräfte üben unterschiedliche
auf die gemeinsamen Atompaare aus Anziehungskräfte aus
![]()
![]() Atome werden etwa gleich Das
größere Atom
Atome werden etwa gleich Das
größere Atom
Häufig umkreist wird häufiger
Umkreist
![]() Bildung eines
Dipols
Bildung eines
Dipols
= unpolare Atombindung = polare Atombindung
Die Bindungsart läst sich mit Hilfe des Elektronegativitätswert bestimmen.
Elektronegativitätswert bestimmen
Differnz ermitteln
Mit Grenzwerten vgl.
Grenzwerte:
Größer 1,7 = Ionenbeziehung
größer oder gleich 1,7 = Atombindung
bei Atombindung: größer 0,4 = polare AB
kleiner oder gleich 0,4 = unpolare AB
z.B. MgO
Mg = 1,2
O = 3,5
2,3 = Ionenbeziehung
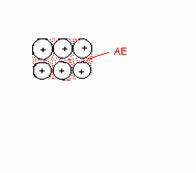
Bindungen in Metallen = Metallbindungen
Metallatome besitzen relativ wenig AE
nur geringe Anziehungskräfte zwischen AE und 'ihrem' Atom
![]()
![]()
![]()
![]()
![]() Me- Atom Metall-
Ion + AE´s sind leicht
verschiebbar
Me- Atom Metall-
Ion + AE´s sind leicht
verschiebbar
e-
Wechselwirkung zwischen
![]() Me- +Ion Metall-Ion Metall-
Atomen
Me- +Ion Metall-Ion Metall-
Atomen
Metall- Ionen
![]() freie-
bewegl. e-
freie-
bewegl. e-
= Bindungskräfte
Zusammenfassung:
Haupt | Fügen Sie Referat | Kontakt | Impressum | Nutzungsbedingungen
