Generell lassen sich drei verschiedene Reaktionstypen in der organischen Chemie unterscheiden:
Substitutionsreaktionen (S-Reaktion)
Additionsreaktionen (A-Reaktion)
Eliminierungsreaktionen (E-Reaktion)
Radikalische Substitutionsreaktionen laufen in drei Reaktionschritten ab:
Startreaktion
Ein Radikalbildnermolekül wird unter Energiezufuhr, z.B. Licht (Photolyse) oder Wärme (Thermolyse) in homolytisch, d.h. in zwei gleiche Radikale ( Verbindungen mit einem ungepaarten Elektron) gespalten.
![]() Kettenreaktion
Kettenreaktion
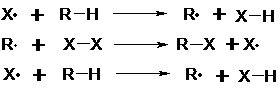
Die durch die Startreaktion entstandenen Moleküle entreißen dem
Kohlenwasserstoffmolekül, an dem Substitution stattfinden soll, ein H-Atom. Es
entsteht ein neues Kohlenwasserstoff-Radikal. Dieses kann nun seinerseits aus
einem Substituentenmolekül ( oben mit X-X gekennzeichnet) eine
Substituentengruppe abspalten. Dabei entsteht erneut ein Radikal, so daß die
Reaktion den Zyklus weiter durchlaufen kann ( die neu entstandenen Radikale ersetzen wiederum H-Atome usf.).
Kettenabbruchsreaktion
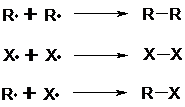
Die Reaktion kommt beispielsweise durch Rekombination zweier Radikale zum Stillstand.
Eine zweite Möglichkeit des Kettenabbruchs ist eine sog. Disproportionierung, d.h. daß bei zwei radikalischen Molekülen zum einen die Oxidationszahlen des beteiligten Kohlenstoffs sinken, beim anderen steigen
![]()
Beispiel:
Allgemein gesehen ist eine nukleophile Reaktion eine chemische Umsetzung, in der ein nukleophiles ( d.h. entweder negativ geladenes oder polarisiertes oder ein solches mit freiem Elektronenpaar) Reagens einen Molekülbereich, in dem Elektronenmangel herrscht, angreift. Ein nukleophiles Reagens oder Agens gibt Elektronen an das Substrat ab, wirkt also als Reduktionsmittel.
Man unterscheidet zwei unterschiedliche Mechanismen: SN1- und SN2-Reaktionen.
SN1-Reaktion ( monomolekulare nukleophile Substitution)
Dieser Mechanismus soll im folgenden exemplarisch an der Umsetzung von 2-Brom-2-Methylpropan mit OH- erläutert werden.
In einer langsam laufenden Reaktionsschritt (geschwindigkeitsbestimmend) wird zunächst das 2-Brom-2-Methylpropan unter Mitwirkung des Lösemittels Wasser gespalten.
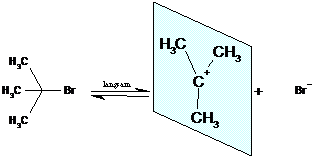
Das sich bildende, positive Carbeniumion ist planar gebaut ( angedeutet durch die eingezeichnete Ebene). Es stabilisiert sich in einem zweiten Reaktionschritt durch eine schnelle Ionenreaktion mit OH-. Die Anlagerung kann von beiden Seiten erfolgen.
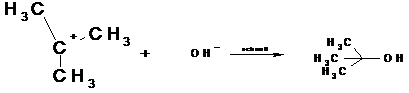
Die Reaktionsgeschwindigkeit der SN1- Reaktion ist nur von der Konzentration des Substrats abhängig, nicht von der OH- - Konzentration.
SN2 - Reaktion (bimolekulare nukleophile Substitution)
Eine Reaktion nach diesem Mechanismus kann erfolgen, wenn das nukleophile Reagens auf der der zu substituierenden Gruppe abgewandten Molekülseite liegt. Bei einer Annäherung beider Reaktionspartner kommt es zu einem planaren Übergangszustand, in dem sowohl die eintretende Gruppe schon als auch die austretende noch locker an das zentrale C-Atom gebunden sind.
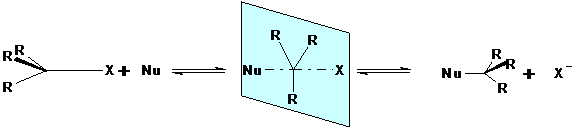
Der Übergangszustand stabilisiert sich durch Abgabe der zu substituierenden Gruppe. Hierbei findet eine räumliche Umordnung der Reste nach Art eines umgestülpten Regenschirms statt. Dieses stereometrische Phänomen wird Waldensche Umkehrung genannt. Die Reaktionsgeschwindigkeit hängt von der Konzentration beider Reaktionspartner ab.
Eine elektrophile Reaktion ist ein chemischer Vorgang, bei dem ein Reagens ein elektronenreiches Zentrum im Substrat angreift. Den angreifenden Reaktionspartner nennt man elektrophiles Reagens. Dieses nimmt Elektronen auf, wirkt also als Oxidationsmittel.
Die elektrophile Substitution ist die typische Reaktion für die Substitution an aromatischen Systemen. Als Beispiel soll die Bromierung von Benzol dienen.

Die Reaktion beginnt mit der annäherung eines Brommoleküls an die
delokalisierten p-Elektronen des aromatischen Systems. Diese lose
Wechselwirkung wird p-Komplex genannt.
p-Komplex
s-Komplex
Das nun polarisierte Brommolekül wird durch eine Lewis-Säure
(Verbindung mit Elektronenlücke, z.B. FeBr3 gespalten. Das positivierte
Bromatom lagert sich unter Ausbildung einer s-Bindung
an das aromatische System an, es kommt zur Ausbildung eines s-Komplexes.
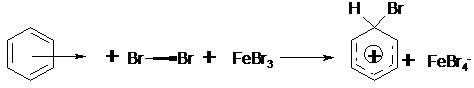
Der s-Komplex ist relativ instabil, da der die Homogenität des aromatischen Systems stört. Er stabilisiert sich durch Abspaltung eines H+
Radikale vermögen die p-Bindungen in C-C- Doppel-
und -Dreifachbindungen wegen deren geringer Stabilität zu 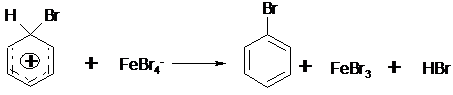 entkoppeln und damit
den Reaktionsstart einzuleiten. Dabei
reagiert das Radikal mit einem durch die Entkoppelung ungepaart vorliegenden
Elektron. Die folge ist die Bildung eines C-Radikals, das seinerseits mit einem
aus dem angreifenden Reagens gebildeten Radikal unter Absättigung reagiert.
entkoppeln und damit
den Reaktionsstart einzuleiten. Dabei
reagiert das Radikal mit einem durch die Entkoppelung ungepaart vorliegenden
Elektron. Die folge ist die Bildung eines C-Radikals, das seinerseits mit einem
aus dem angreifenden Reagens gebildeten Radikal unter Absättigung reagiert.
Der erste Reaktionsschritt entspricht dem der radikalischen Substitution: durch Energiezufuhr werden Radikale gebildet.
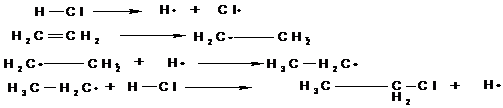
Der zweite
Reaktionsschritt besteht im radikalischen Angriff auf die p-Bindungen. Es kommt zur
Bildung eines C-Radikals. Im dritten Reaktionsschritt kommt es zum
Kettenabbruch durch Kombination zweier Radikale.
Elektrophile Addition (SE-Reaktionstyp)
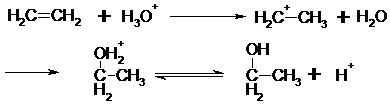
Die
elektrophile Addition verläuft analog zur SE-Reaktion. Es kommt, mit
Umweg über den p-Komplex zur Bildung
eines Carbeniumions. Das nukleophile Teilchen lagert sich an das positive
Zentrum an, es kommt zur Ausbildung des Additionsproduktes (durch Abspaltung
von H+).
Eliminierungen kann man als Umkehrung der Addition auffassen.
Im ersten Reaktionsschritt kommt es zur Bildung eines Carbeniumsions durch X aus dem Molekülverband. Dieser langsame Primärschritt bestimmt die Geschwindigkeit der Reaktion.
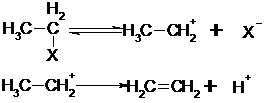
Der zweite
Reaktionsschritt: ein Proton löst sich, wodurch das im ersten Reaktionsschritt
gebildete Ion vernichtet und das Gesamtmolekül stabilisiert wird.