1. Einleitung
Für die Behandlung des Verhaltens realer Gase ist es hilfreich , sich zunächst mit den Grundlagen der Theorie der sogenannten idealen Gase vertraut zu machen . Dadurch , daß kein Gas exakt den Gesetzen der idealen Gase folgt , ergibt sich erst die Notwendigkeit , sich mit realen Gasen genauer zu beschäftigen und eigene Gesetzmäßigkeiten für sie zu entwickeln . Bei der Betrachtung eines idealen Gases wird außer Acht gelassen , daß die Gasmoleküle ein Eigenvolumen besitzen , welches das Gesamtvolumen des Gases , wenn zunächst auch nur geringfügig , beeinflußt . Ebenso wird z.B. nicht berücksichtigt , daß im Gas intermolekulare Wechselwirkungen ( Anziehungskräfte ) herrschen , die das Verhalten des Gases im geschlossenen Raum beeinflussen . Da Meßergebnisse durch diese Faktoren unter normalen Bedingungen nicht sehr stark beeinflußt werden , genügt es häufig , das Verhalten realer Gase über die Gleichungen der idealen Gase zu bestimmen und die entstehenden Fehler nicht zu berücksichtigen . Die Fehler , die hierbei auftreten , werden zudem mit kleiner werdendem Druck und steigender Temperatur , also mit zunehmender Verdünnung des Gases , zunehmend kleiner . Für genauere Ergebnisse , die reale Gase betreffen , bedarf es aber einiger verbesserter Zustandsgleichungen , die die oben genannten Faktoren ( Eigenvolumen etc. ) berücksichtigen . Im nächsten Kapitel soll zunächst aber nur das Verhalten der idealen Gase ( eigentl. "das ideale Gas" , da es nur das eine , theoretische Modell gibt )beschrieben werden.
Im dritten Kapitel werden dann die realen Gase mit ihren Zustandsgleichungen beschrieben . Sollte hier nichts anderes erwähnt sein , gelten alle Gleichungen und Aussagen für jeweils ein mol des Gases , da dies die zur Berechnung am häufigsten benutzte Gasmenge ist .
Ideale Gase
![]() (a)
(a)
Nun kann man nach dem BOYLE-MARIOTTEschen Gesetz die
Volumenänderung von ![]() auf V bei konstant
gehaltener Temperatur durch Anderung des Druckes von
auf V bei konstant
gehaltener Temperatur durch Anderung des Druckes von ![]() auf den Druck p
berechnen . Hier gilt für das neue Volumen V :
auf den Druck p
berechnen . Hier gilt für das neue Volumen V :
![]()
oder : ![]() (b)
(b)
Nun setzt man in Gleichung (b) ![]() aus Gleichung (a) ein
und erhält so folgende Gleichung :
aus Gleichung (a) ein
und erhält so folgende Gleichung :
![]() (c)
(c)
Eine Division durch T ergibt dann :
![]() (d)
(d)
Diese Gleichung (d) sagt aus , daß der Term ![]() für ein ideales Gas
immer konstant ist , sich also auch berechnen läßt , da der Wert bei den
Ausgangsbedingungen der gleiche ist wie bei beliebigen Endwerten . Diese Konstante hat , je nachdem , welche
Einheiten man für Druck ,
für ein ideales Gas
immer konstant ist , sich also auch berechnen läßt , da der Wert bei den
Ausgangsbedingungen der gleiche ist wie bei beliebigen Endwerten . Diese Konstante hat , je nachdem , welche
Einheiten man für Druck ,
Temperatur und Volumen verwendet , verschiedene Werte .
Diese Konstante wächst, bei gleichem Druck , Volumen und Temperatur , proportional mit der Teilchenzahl .
Bei 1 atm Druck , 0°C und dem daraus resultierenden
Molvolumen von 22,414 ![]() ergibt sich dann als universelle Gaskonstante R folgender
Wert :
ergibt sich dann als universelle Gaskonstante R folgender
Wert :
R =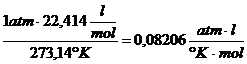
(siehe auch : BRDIČKA : Grundlagen der physikal. Chemie , S.196)
pV=RT
Für n mole Gas wäre entsprechend :
pV=nRT
In den allermeisten Fällen gehen alle anderen Gleichung von dieser Tatsache , daß der Druck multipliziert mit dem Volumen gleich der Temperatur multipliziert mit einer Konstanten ( und gegebenenfalls mal die Anzahl der mole ) ist , aus , oder werden von ihr abgeleitet - auch die meisten Gleichungen der realen Gase , wie wir noch sehen werden .
![]()
2.1. Das Verhalten idealer Gase
Die Gleichung ![]() , nach p aufgelöst ,
ergibt nun die Funktion
, nach p aufgelöst ,
ergibt nun die Funktion
![]() , (e)
, (e)
die bei jeweils konstanter Temperatur und für ein mol ideales Gas , ein p-V-Diagramm mit folgenden Graphen ergibt :
Die Graphen dieser Funktion haben alle einen zweiten Arm , der genau symmetrisch zur y-Achse verläuft . Dieser läßt sich hier jedoch vernachlässigen , da diese Funktionswerte ein negatives Volumen voraussetzen würden , was physikalisch unmöglich ist .
Deutlich zu sehen ist hier , daß sämtliche Graphen streng monoton fallend sind , was auch die Ableitung zeigt . Sie lautet :
![]() (f)
(f)
Sie ist im gesamten Bereich ![]() negativ , da der
Zähler hier immer negativ und der Nenner
immer positiv ist . Diese Graphen sind auch anschaulich logisch zu erklären ,
da sich mit steigendem Druck von außen das Volumen stetig verkleinern muß .
negativ , da der
Zähler hier immer negativ und der Nenner
immer positiv ist . Diese Graphen sind auch anschaulich logisch zu erklären ,
da sich mit steigendem Druck von außen das Volumen stetig verkleinern muß .
Diese Graphen zeigen auch , daß sich ein ideales Gas nicht verflüssigen läßt , bei keinem beliebig hohen Druck und keiner beliebig niedrigen Temperatur ! Eine Verflüssigung würde nämlich bedeuten , daß der Graph bei einem bestimmten Druck waagerecht zur x-Achse laufen müßte , das Volumen also bei gleichbleibendem Druck stark verringert würde , was in der Realität Meßergebnisse zeigen würden . Wenn die Ableitung (f) jedoch keine Nullstelle hat , ist die Ausgangsfunktion streng monoton fallend :
![]() (g)
(g)
Gleichung (g) hat nur eine Lösung für T=0 , hier wäre der Druck aber 0 für alle Volumina , was physikalisch unmöglich ist . Für alle Temperaturen über 0°K ergibt sich jedoch keine Lösung für diese Gleichung (g) . Sie zeigt für Temperaturen über 0°K obige Kurvenschar , deren Kurven keine Nullstelle haben , was heißt , daß die Ausgangskurven tatsächlich streng monoton fallend sind , da hier für alle Temperaturen (ausgenommen 0°K)
der Monotoniesatz gilt , der besagt , daß eine
Funktion f(x) streng monoton fallend ist , wenn für alle x gilt : ![]() <0 , was hier zutrifft .
<0 , was hier zutrifft .
Eine Verflüssigung kommt durch die Anziehungskräfte der Moleküle untereinander zustande .Da diese , wie schon in der Einleitung erwähnt , bei idealen Gasen jedoch nicht berücksichtigt werden , ließe sich ein ideales Gas also nicht verflüssigen - es wäre , da die Moleküle eines idealen Gases kein Eigenvolumen besitzen , unendlich weit kompressibel, bis zu einem Volumen von 0 . Da sich aber jedes Gas , nötigenfalls bei
sehr hohen Drücken und / oder sehr tiefen Temperaturen , verflüssigen
läßt , und auch kein Gas das Volumen 0 einnehmen kann , tritt bei den Gleichungen der idealen Gase zur Beschreibung der realen Gase offensichtlich ein Fehler auf , der besonders schwerwiegend ist , wenn man nun den Vorgang des Verflüssigens von Gasen berechnen möchte . Um das Eigenvolumen , die Wechselwirkungen u.s.w. zu berücksichtigen ,
bedürfen die Zustandsgleichungen der idealen Gase anscheinend einiger Korrekturen .
3. Reale Gase
Im 19. Jahrhundert haben sich viele Wissenschaftler
mit dem Verhalten von Gasen und besonders mit dem Vorgang des Verflüssigens
beschäftigt . Hierbei haben sie festgestellt , daß die experimentell
ermittelten Kurven nicht ganz den Kurven der idealen Gase folgen , sondern von
ihnen abweichen . Dies ist besonders stark in dem Bereich der Kurve zu sehen ,
in dem sich das Gas verflüssigt . Da die Zustandsgleichungen der idealen Gase
keine Verflüssigung vorsehen , mußten sie korrigiert werden . In den
Gleichungen mußten das Eigenvolumen der Gasmoleküle sowie die intermolekularen
Wechselwirkungen berücksichtigt werden , um reale Gase besser zu beschreiben . J.
van der Waals hat die wohl bekannteste Gleichung , die wohl auch am
häufigsten benutzt wird , aufgestellt . Er hat die ideale
Zustandsgleichung ![]() ( für 1 mol Gas )
folgendermaßen korrigiert :
( für 1 mol Gas )
folgendermaßen korrigiert :
Er subtrahierte vom Volumen V einen Teil b , der
inkompressibel ist , also das Eigenvolumen der Gasmoleküle darstellt .
Zusätzlich addierte er zum Druck p den sogenannten Binnendruck , der im Gas
herrscht . Dieser Teil stellt die Anziehungskräfte zwischen den Molekülen dar .
Prallen Moleküle an eine Wand , so überwiegen die Anziehungskräfte der Moleküle
, die nach innen wirken . Diese Kraft ist proportional der Anzahl der
Moleküle in der Volumeneinheit des Gases bzw. seiner Dichte . Die Anzahl der
Moleküle in der Grenzfläche ist ihrerseits jedoch auch der Dichte des Gases
proportional , so daß der resultierende innere Druck proportional dem Quadrat
der Dichte oder umgekehrt proportional dem Quadrat des Molvolumens ist![]() . So ergibt sich die zentrale Zustandsgleichung der realen
Gase , die van-der-Waalssche Gleichung ( hier für 1 mol ) :
. So ergibt sich die zentrale Zustandsgleichung der realen
Gase , die van-der-Waalssche Gleichung ( hier für 1 mol ) :
![]() RT (h)
RT (h)
Der Proportionalitätsfaktor a , der für die Anziehungskräfte steht , und der Wert b sind für jedes Gas unterschiedliche Werte , wobei b nach van der Waals gleich dem vierfachen des Eigenvolumens der Moleküle ist .
3.1. Das Verhalten realer Gase
Diese Zustandsgleichung (h) nach p aufgelöst ergibt die Gleichung
![]() , (i)
, (i)
die
als Funktion ![]() folgende Kurven ergibt
, bei denen die Temperatur jeweils konstant gehalten wurde und für a und b die
idealen Werte für Wasser , nämlich a=5,58 und b=0,031 und R=0,08206 eingesetzt
wurden , die in entsprechenden Einheiten angegeben werden müssen , damit sie in
der Gleichung angewandt werden können .
folgende Kurven ergibt
, bei denen die Temperatur jeweils konstant gehalten wurde und für a und b die
idealen Werte für Wasser , nämlich a=5,58 und b=0,031 und R=0,08206 eingesetzt
wurden , die in entsprechenden Einheiten angegeben werden müssen , damit sie in
der Gleichung angewandt werden können .
In folgender Tabelle sind die Parameter für einige Stoffe angegeben :
Stoff a ( ![]() ) b (
) b ( ![]() )
)
![]() 0,192 0,022
0,192 0,022
![]() 5,58 0,031
5,58 0,031
![]() 1,37 0,039
1,37 0,039
![]() 1,38 0,032
1,38 0,032
![]() 3,67 0,043
3,67 0,043
( aus : Greiner,Neise,Stöcker : Thermodyn. und Statist. Mathem . ; S.20 )
Deutlich
zu sehen ist bei Kurven unter 647°K , daß sie ein lokales Minimum sowie ein
lokales Maximum und zwei Wendepunkte haben . Hier erhält man für einen Druck
drei Werte für das Molvolumen . Oberhalb dieser Temperatur erhält man nur einen
reellen Wert ( hyperbelartiger Verlauf ) . Unterhalb von 647°K sind es jedoch
Kurven 3. Ordnung . Hier lassen sich auch , sofern vorhanden , die Nullstellen
der Funktion berechnen . Der Bereich zwischen den Nullstellen ist physikalisch
gesehen völlig irreal , da hier der Druck negativ wäre . Das bedeutet , hier
wäre der Binnendruck a zu groß . Das
gilt z.B. für Wasser bei der Temperatur 473°K im Intervall ![]() , da die Nullstellen der Funktion hier liegen :
, da die Nullstellen der Funktion hier liegen :
![]() RT
RT
nach p aufgelöst mit a=5,58 , b=0,031 , R=0,08205 und T=473°K und gleich null gesetzt :
![]() (j)
(j)
Nullstellen
: ![]()
![]()
Außerdem haben die Kurven unterhalb von 647°K einen Abschnitt zwischen den lokalen Extrema , in dem der Graph steigt . Das bedeutet , daß hier mit abnehmendem Druck auch das Volumen kleiner wird , das Gas verdichtet sich selbständig , was zunächst unmöglich erscheint . In diesem Bereich findet jedoch die Verflüssigung des Gases statt , die Anziehungskräfte der Moleküle ziehen das Gas sozusagen zusammen .
Oberhalb der 647°K gibt es diese Extrema nicht mehr , das heißt , das Gas kann nicht verflüssigt werden , auch nicht bei dem größten Druck oder dem kleinsten Volumen . Die Temperatur , oberhalb der es nicht mehr möglich ist , ein Gas zu verflüssigen , nennt man Boyle -Temperatur oder auch , seltener , kritische Temperatur . Sie beträgt z.B. bei Wasser 647°K oder 374°C .
Um nun den Bereich auf dem Graphen zu bestimmen , in dem die Verflüssigung stattfindet , muß durch einen Punkt auf dem Graphen ,
der zwischen dem Minimum und dem Maximum liegt , eine Gerade ,
die parallel zur x-Achse läuft , gezogen werden . Die beiden Flächen zwischen der Geraden und dem Graphen , die über dem Minimum bzw. unter dem Maximum liegen , müssen zusätzlich exakt gleich groß sein .
Diese Gerade schneidet den Graphen dreimal , nämlich einmal links des Minimums , zwischen den Extrema und rechts des Maximums . Die Schnittpunkte der Geraden mit dem Graphen links und rechts der lokalen Extrema zeigen nun die Grenzen des Phasenüberganges an . Erhöht man den Druck , beginnt das Gas beim Schnittpunkt rechts des Maximums , sich zu verflüssigen und ist beim Schnittpunkt links des Minimums vollständig verflüssigt . Ab hier ist die Steigung der Kurve viel stärker negativ , was bedeutet , daß auch große Druckerhöhungen nur kleine Volumenverkleinerungen bewirken , was auch anschaulich logisch ist , da sich eine Flüssigkeit schwieriger komprimieren läßt als ein Gas .
Die Gerade zeigt auch den Verlauf der Kurve an , die experimentell ermittelt werden würde , da hier das Volumen bei einem bestimmten Druck plötzlich kleiner wird ohne , daß der Druck weiter erhöht wird .
Im Experiment kann es auch den Bereich , in dem mit steigendem Druck das Volumen größer wird ( zwischen den Extrema ) , nicht geben .
3.2. Berechnung der Konstanten
Der
Druck , der bei der kritischen Temperatur ![]() ( Boyle-Temperatur )
( Boyle-Temperatur )
aufgewendet
werden muß , um das Gas zu verflüssigen , wird der kritische Druck ![]() genannt . Das Volumen
des Gases bei der kritischen Temperatur und dem kritischen Druck ist das
kritische Volumen
genannt . Das Volumen
des Gases bei der kritischen Temperatur und dem kritischen Druck ist das
kritische Volumen ![]()
![]() . Sie können experimentell bestimmt werden oder auch
rechnerisch , wie im folgenden gezeigt wird . Die kritischen Werte eines Gases
hängen nämlich mit den Konstanten a und b der van-der-Waals - Gleichung
zusammen . Um sie zu berechnen , benötigt man die van-der-Waalssche Gleichung
für den kritischen Zustand eines Gases , die lautet :
. Sie können experimentell bestimmt werden oder auch
rechnerisch , wie im folgenden gezeigt wird . Die kritischen Werte eines Gases
hängen nämlich mit den Konstanten a und b der van-der-Waals - Gleichung
zusammen . Um sie zu berechnen , benötigt man die van-der-Waalssche Gleichung
für den kritischen Zustand eines Gases , die lautet :
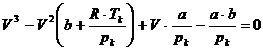 (k)
(k)
Aus
der Tatsache , daß im kritischen Punkt alle drei Wurzeln der kubischen
Gleichung für V gleich dem kritischen Volumen ![]() sind , folgt
sind , folgt
![]()
![]()
![]() (l)
(l)
Diese Gleichung (l) ausmultipliziert ergibt nun :
![]() (m)
(m)
Jetzt können die Koeffizienten der Gleichungen (k) und (m) miteinander verglichen werden , und man erhält :
![]() ;
; ![]() ;
; ![]() (n)
(n)
Hieraus ergibt sich :
![]() (o)
(o)
Jetzt kann man in (n) einsetzen :
![]()
![]()
![]() (p)
(p)
Multipliziert
mit ![]() und dann dividiert
durch
und dann dividiert
durch ![]() :
:
![]()
![]()
![]()
Gekürzt
ergibt sich dann für ![]() :
:
![]() (q)
(q)
Jetzt setzt man die Gleichungen (o) und (r) in
![]() ein
ein
und
kann so ![]() folgendermaßen
bestimmen :
folgendermaßen
bestimmen :
![]() (r)
(r)
Division
durch ![]() :
:
![]() (s)
(s)
Division durch 9b :
![]() (t)
(t)
Durch Kürzen erhalten wir jetzt :
![]() oder
oder ![]() (u)
(u)
Also erhalten wir zusammengefaßt folgende Definitionen der kritischen Werte eines realen Gases mit Hilfe der van-der-Waalsschen Konstanten a und b :
![]() ;
; ![]() ;
; ![]()
Man kann umgekehrt auch die van-der-Waalsschen Konstanten über die kritischen Konstanten bestimmen , die experimentell bestimmt werden können . Folglich können die Konstanten a und b , sowie die universelle Gaskonstante R auch auf experimentellem Wege bestimmt werden :
Durch
Umformung von ![]() ergibt sich :
ergibt sich :
![]()
Ebenso
durch Umformung ergibt sich aus ![]() :
:
![]()
Die Gaskonstante R ergibt sich wie folgt :
In ![]() setzen wir für a und b
die oben ermittelten Werte ein :
setzen wir für a und b
die oben ermittelten Werte ein :
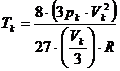 (v)
(v)
Die Klammern aufgelöst ergibt und mit R multipliziert ergibt :
![]() (w)
(w)
Durch ![]() geteilt und gekürzt
ergibt schließlich :
geteilt und gekürzt
ergibt schließlich :
![]() (x)
(x)
(siehe auch zu 3.2. : BRDIÇKA ; Grundlagen der physikal. Chemie , S.253 f.)
3.3. Weitere Zustandsgleichungen
Eine weitere häufig benutzte Zustandsgleichung zur Beschreibung des Verhaltens realer Gase ist die CLAUSIUSsche Virialgleichung . Sie ist im Prinzip ebenfalls eine erweiterte Zustandsgleichung der idealen Gase . Sie lautet :
![]() .
.
Die Koeffizienten B,C,D nennt man Virialkoeffizienten , die für jedes Gas unterschiedlich sind . Sie sind von der Temperatur abhängig . Zur Vereinfachung wird häufig beim linearen Term abgebrochen :
![]()
![]()
Wird die Zustandsgleichung nicht nach dem Druck , sondern nach der Dichte entwickelt , sieht die Virialentwicklung folgendermaßen aus :
![]()
(aus : Greiner , Neise , Stöcker : Thermodynamik und statistische Mechanik , S.18)
Natürlich können alle Gleichungen auch für eine beliebige Teilchenzahl und nicht unbedingt für ein mol Gas aufgestellt werden , am häufigsten wird jedoch diese Menge betrachtet . Die ideale Zustandsgleichung lautet dann z.B. für N Teilchen :
![]() (y)
(y)
Die
Konstante k ist die BOLTZMANNsche Proportionalitätskonstante , deren Wert ![]() beträgt
beträgt![]() . Bei
. Bei ![]() Teilchen , also gerade
einem mol Teilchen , ergibt sich für
Teilchen , also gerade
einem mol Teilchen , ergibt sich für ![]() die Gaskonstante R
, womit die Gleichung wieder
die Gaskonstante R
, womit die Gleichung wieder ![]() lautet . Ebenso läßt
sich auch die van-der-Waalssche Gleichung für N mol anwenden :
lautet . Ebenso läßt
sich auch die van-der-Waalssche Gleichung für N mol anwenden :
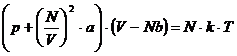 (z)
(z)
(siehe hierzu auch : Greiner,Neise,Stöcker:Thermodyn. Und statist. Mechanik ,S.8,18,19)
Es
gibt auch eine vereinfachte Form der van-der-Waals-Gleichung , bei der nach
Auflösen der Klammern das Glied ![]() vernachlässigt wird ,
da es in vielen Fällen , wenn man für V=
vernachlässigt wird ,
da es in vielen Fällen , wenn man für V=![]() setzt , um den Wert 1 liegt , und bei
setzt , um den Wert 1 liegt , und bei ![]() ebenfalls für V nach
der idealen Zustandsgleichung
ebenfalls für V nach
der idealen Zustandsgleichung ![]() eingesetzt wird . Dann
erhält man :
eingesetzt wird . Dann
erhält man :
![]() (A)
(A)
(siehe : BRDIČKA : Grundlagen der physikal. Chemie , S. 247 )
Vergleicht man diese Gleichung mit der CLAUSIUSschen Virialentwicklung , die beim linearen Term abgebrochen wurde , so sieht man , daß
![]() sein muß . Diese
Gleichung (A) zeigt auch , wie stark der Term
sein muß . Diese
Gleichung (A) zeigt auch , wie stark der Term ![]() bei realen Gasen vom Wert RT bei idealen Gasen
abweicht . Bei niedrigen Temperaturen ist der Term
bei realen Gasen vom Wert RT bei idealen Gasen
abweicht . Bei niedrigen Temperaturen ist der Term ![]() >b , so daß
>b , so daß ![]() mit steigendem Druck
abnimmt , bei hohen Temperaturen ist b>
mit steigendem Druck
abnimmt , bei hohen Temperaturen ist b>![]() ,
, ![]() vergrößert sich also
mit steigendem Druck . Die Temperatur , bei der
vergrößert sich also
mit steigendem Druck . Die Temperatur , bei der ![]() ist , ist die
kritische Temperatur , oder auch Boyle-Temperatur .
ist , ist die
kritische Temperatur , oder auch Boyle-Temperatur .
(vgl. hierzu : BRDIÇKA , Grundlagen der physikal. Chemie , S.247)
Abschließend hier noch einmal alle wichtigen Gleichungen und Beziehungen :
Die ideale Zustandsgleichung für ein mol :
![]()
und für n mol :
![]()
wobei ![]() , je nach verwendeten
Einheiten , z.B.
, je nach verwendeten
Einheiten , z.B.
![]() ist .
ist .
Die van-der-Waalssche Zustandsgleichung der realen Gase lautet für ein mol :
![]()
oder für N Teilchen :
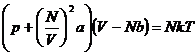
Die van-der-Waals-Gleichung nach p aufgelöst , ergibt die Funktion
![]() ,
,
deren Graphen das p-V-Diagramm der realen Gase zeigen .
Die
Konstanten a , b und R stehen folgendermaßen mit den kritischen
Werten ![]() und
und ![]() in Zusammenhang :
in Zusammenhang :
![]() ;
; ![]() ;
; ![]()
und
![]() ;
; ![]() ;
; ![]()
Die Clausiussche Virialgleichung lautet , wenn sie nach Drücken entwickelt wird :
![]() .
.
Sie
wird der Einfachheit halber jedoch häufig beim linearen Glied abgebrochen . Im
Vergleich mit der vereinfachten van-der-Waalsschen Gleichung ![]() sieht man , daß der
Koeffizient B gleich
sieht man , daß der
Koeffizient B gleich
![]() sein muß .
sein muß .
Literaturverzeichnis
BRDIČKA : Grundlagen der physikalischen Chemie
Berlin 1977
Greiner , Neise , Stöcker : Thermodynamik und
statistische Mechanik
Frankfurt a.M. 1987
Schülerduden : Die Chemie
Kurzverweise :
![]() : BRDIČKA :
Grundlagen der physikalischen Chemie
: BRDIČKA :
Grundlagen der physikalischen Chemie
S. 246
![]() : BRDIČKA :
Grundlagen der physikalischen Chemie
: BRDIČKA :
Grundlagen der physikalischen Chemie
S. 250
![]() : BRDIČKA :
Grundlagen der physikalischen Chemie
: BRDIČKA :
Grundlagen der physikalischen Chemie
S. 253
![]() : Greiner , Neise ,
Stöcker : Thermodynamik und
: Greiner , Neise ,
Stöcker : Thermodynamik und
statistische Mechanik , S.9
Haupt | Fügen Sie Referat | Kontakt | Impressum | Nutzungsbedingungen
